Проклятая дюжина
Содержание:
- Резистентность к антибиотикам
- Методы определения антибиотикорезистентности
- Механизм лекарственной устойчивости грибков и простейших
- Что такое устойчивость к антибиотикам?
- Жизнь без антибиотиков
- Когда использовать антибиотики?
- Устойчивость к тетрациклину
- Профилактика и борьба
- Резистентность к антибиотикам
- Устойчивость к антибиотикам, содержащим бета-лактамное кольцо (к пенициллину, цефалоспорину)
- Как справиться с явлением резистентности?
- Поколения и резистентность
- Правила забора материала для антибиотикограммы
- О причинах и механизмах
- Что такое резистентность?
Резистентность к антибиотикам
Самый интересный пример резистентности можно рассмотреть на примере способностей бактерий, отличающихся удивительной способностью к выживанию.
Еще 15 лет назад в Дании на научной конференции, посвященной проблеме антибиотикорезистентности, сама глава ВОЗ М.Чен, отбросив всякую дипломатию, заявила о наступлении новой эры, высказав опасения, что той медицине, которую мы знаем сегодня, наступает конец.
Спустя максимум два, три десятилетия, если не принять экстренные меры, человечество начнет умирать от инфекций при обычной царапине, не говоря уже о серьезных заболеваниях.
Еще относительно недавно, изобретение пенициллина дало надежду на полную победу над бактериальными инфекциями. Но не тут-то было. Прошли годы, но изобретения ни 1-го, ни 2-го, ни 3-го, ни даже 4-го поколения антибактериальных препаратов не дало желаемых результатов.
Мутация бактерий происходит с такой скоростью, что опережает изобретение новых препаратов.
Бактерии не живут поодиночке, они обитают популяциями. В своих «сообществах» научились общаться между собой и как настоящие воины выстраивать защиту и тактику нападения.
Многие из них обладают природной резистентностью, иные – приобрели устойчивость в результате мутации, используя разные механизмы для выживаемости:
- синтезируя ферменты (что это?), разрушающие активный компонент антибиотиков или модифицируя их молекулы;
- изменяя РНК-синтетаз и рибосом, проницаемость своих клеточных стенок или полностью всю клеточную структуру;
- нарушая процессы транспорта антибиотика к бактериальным клеткам.
К тому же одна и та же бактерия способна использовать для выживания несколько эффективных механизмов. С каждым годом появляются все новые и новые неизвестные популяции.
В США обнаружена популяция различных штаммов, так называемых кошмарных бактерий (CRE), устойчивых даже к самым новейшим классам антибиотиков. Бессимптомное инфицирование не дает возможность проследить их распространение. За прошедший год инфицировано до 10 000 человек, 600 из которых погибло.
В Индии от неизвестной бактерии, резистентной ко всем известным видам антибиотиков, погибло более 5 000 человек. В это время ученые из США изобрели препарат «Тиенам», способный, согласно всем своим параметрам, справиться с самыми опасными микроорганизмами. Кстати, не из дешевых – 600 долларов за дозу.
Каково же было удивление, когда, наблюдая в микроскоп за поведением микроорганизма, изобретатели увидели, как один конец бактерии с аппетитом поедает препарат, а другой, выплевывает его остатки. Как говорится – 600 долларов бактерии под хвост.
Во время раскопок в пещере Лечугилье (США) на глубине 300 метров ученые обнаружили бактерии, возраст которых – 4 000 000 лет. Анализ на резистентность показал, что они устойчивы по отношению к 18 современных антибиотиков, включая последние разработки.
Это говорит о том, что эволюция позаботилась о механизме их резистентности задолго до появления потенциальной опасности, в виде антибиотиков.
Методы определения антибиотикорезистентности
При создании новых антибактериальных препаратов очень важно четко определить его свойства: как они действуют и в отношении каких бактерий эффективны. Определить это можно лишь при помощи лабораторных исследований
Анализ на антибиотикорезистентность можно провести с использованием различных методов, самыми популярными из которых считаются:
- Метод дисков, или диффузия АМП в агар по Кирби-Байер
- Метод серийных разведений
- Генетическая идентификация мутаций, вызывающих лекарственную резистентность.
Первый метод на сегодняшний день считается самым распространенным благодаря дешевизне и простоте исполнения. Суть метода дисков заключается в том, что выделенные в результате исследований штаммы бактерий помещают в питательную среду достаточной плотности и накрывают пропитанными раствором АМП бумажными дисками. Концентрация антибиотика на дисках отличается, поэтому когда происходит диффузия препарата в бактериальную среду, можно наблюдать градиент концентраций. По величине зоны отсутствия роста микроорганизмов можно судить об активности препарата и рассчитать эффективную дозировку.
Вариантом метода дисков служит Е-тест. В этом случае вместо дисков применяют полимерные пластины, на которые наносится определенная концентрация антибиотика.
Недостатками этих методов считается неточность вычислений, связанная с зависимостью градиента концентраций от различных условий (плотности среды, температуры, кислотности, содержания кальция и магния и т.д.).
Метод серийных разведений основан на создании нескольких вариантов жидкой или плотной среды, содержащих различные концентрации исследуемого препарата. Каждый из вариантов заселяют определенным количеством исследуемого бактериального материала. По окончании инкубационного периода оценивают рост бактерий или его отсутствие. Этот метод позволяет определить минимально-эффективную дозу препарата.
Метод можно упростить, взяв за образец всего 2 среды, концентрация которых будет максимально близка к минимуму, необходимому для инактивации бактерий.
Метод серийных разведений по праву считается золотым стандартом определения антибиотикорезистентности. Но из-за дороговизны и трудоемкости он не всегда применим в отечественной фармакологии.
Методика идентификации мутаций дает информацию о наличии у того или иного штамма бактерий видоизмененных генов, способствующих развитию антибиотикорезистентности к конкретным препаратам, и в связи с этим систематизировать возникающие ситуации с учетом сходства фенотипических проявлений.
Этот метод отличается высокой стоимостью тест-систем для его исполнения, тем не менее, его ценность для прогнозирования генетических мутаций у бактерий неоспорима.
Механизм лекарственной устойчивости грибков и простейших
Механизм лекарственной устойчивости грибков и простейших, являющихся по структурной организации эукариотами, изучен менее подробно, чем у прокариотов. Их устойчивость также может быть вызвана изменением (отсутствием) соответствующих структурных компонентов- клетки, синтез которых ингибируется препаратом, или обусловлена выработкой ферментов, модифицирующих препарат. Напр., хлорамфеникол — ингибитор синтеза белка — подавляет рост прокариотической клетки, но не действует на эукариотическую клетку из-за отличий в аппарате, синтезирующем белок. Показано, что этот антибиотик соединяется с рибосомами чувствительных микроорганизмов, но не связывается рибосомами устойчивых форм.
Особенностью лекарственной устойчивости у грибков и простейших является се медленное развитие и появление лишь после многочисленных пересевов в присутствии антибиотика. Это было отмечено в отношении антибиотика нистатина и грибков, дрожжей и лейшманий. У некоторых видов дрожжеподобных грибков рода Candida удавалось получить in vitro устойчивые штаммы к антибиотику трихомицину. Однако в клинике повышенная устойчивость трихомонад и Candida к трихомицину не установлена. Относительная трудность выделения резистентных к антибиотикам штаммов грибков и простейших в сравнении с бактериями, вероятно, связана с отсутствием у них плазмид, контролирующих одновременную устойчивость к нескольким лекарственным препаратам и обладающих способностью транспортироваться из клеток, носителей плазмид, в бесплазмидные.
Сведения о лекарственной устойчивости вирусов весьма ограничены, т. к. химиотерапия вирусных инфекций находится в ранней стадии своего развития из-за отсутствия средств, специфически действующих па метаболизм вирусов, без отрицательного влияния на клетку. Тем не менее в ряде случаев удалось показать принципиальную возможность развития устойчивости некоторых вирусов к препаратам, угнетающим синтез вирусных макромолекул. Так, гуанидин и 2-(альфа-оксибензил)бензимидазол известны как средства, избирательно подавляющие пикорнавирусы и не влияющие на клетку. Механизм действия этих соединений скорее всего связан с первичным угнетением синтеза вирусной РНК. Однако практическое использование этих соединений ограничено высокой частотой появления мутантов вируса, синтез РНК которых устойчив к действию указанных ингибиторов, а у некоторых из мутантов стимулируется этими соединениями.
Библиография: Гершанович В. Н. О механизмах поступления антибиотиков в бактерии, Усп. совр, биол., т. 84, в. 3(6), с. 453, 1977, библиогр.; Гольдфарб Д. М. и Купцова Н. В. Выражение гена резистентности к тетрациклину плазмид R6 и RP4 в бактериях семейства Enterobacteriaceae, Антибиотики, т. 24, №4, с. 273, 1 979; Навашин С. М. и Фомина И. П. Справочник по антибиотикам, с. 11, М., 1974; Терешин. Преодоление лекарственной устойчивости возбудителей инфекционных заболеваний, Л., 1977; Acаr J. F. а. Sabath L. D. Bacterial persistense in vivo, resistance or tolerance to antibiotics, Scand. J. infect. Bis., suppl. 14, p. 86, 1978; Benveniste R.a. Davies J. Mechanisms of antibiotic resistance in bacteria, Ann. Rev. Biochem., v. 42, p. 471, 1973, bibliogr.; Davies J., Courvalin P. a. Berg D. Thougths on the origins of resistance plasmids, J. Antimicrob. Chemother., v. 3, suppl. C., p. 7, 1977, bibliogr.; Franklin T. J. Resistance of Escherichia coli to tetracyclines, Biochem. J., v. 105, p. 371, 1967; Microbial drug resistance, ed. by S. Mit-suhashi a. H. Hashimoto, Baltimore a. o., 1975; Tait R. С. а. Boyer H. W. On the nature of tetracycline resistance, controlled by plasmid pSC 101, Cell, v. 13, p. 73, 1978; Yang H. L., Zubay G. a. Levy S. B. Synthesis of an R-plasmid protein associated with tetracycline resistance is negatively regulated, Proc. nat. Acad. Sci. (Wash.), v. 73, p. 1509, 1976.
Что такое устойчивость к антибиотикам?
Представьте себе ситуацию, когда программист борется с хакером. Чем более совершенную антивирусную программу создаст ИТ-специалист, тем более сложные вирусы будет создавать хакер. После каждого нового вируса, который проник в систему и не был обнаружен и удален существующей антивирусной программой, ИТ-специалист должен подготовить улучшенный алгоритм. Когда на рынке появляется последняя антивирусная программа, хакеры уже начинают работать над другим вирусом, устойчивым к этой программе.
Устойчивость к антибиотикам – аналогичное явление, только оно возникает, когда бактерии приобретают устойчивость. Чем лучше и эффективнее антибиотик представлен на рынке, тем больше бактерий сосредоточено на изменении своих свойств, нейтрализующих свойства нового препарата. Так возникает устойчивость к антибиотикам.
С этой целью бактерии могут изменять свой генетический материал таким образом, что устойчивость к новому антибиотику становится их постоянной характеристикой, передаваемой будущим поколениям. Если с последующей серией лекарств, созданных учеными, бактерии приобретают устойчивость к воздействиям, то мутации в бактериальной ДНК накапливаются и образуют бактериальные штаммы, устойчивые практически к большинству антибиотиков. Этот процесс является основой бактериальной устойчивости к антибиотикам.
Устойчивость к антибиотикам
Жизнь без антибиотиков
Если Вы считаете, что антибиотики – слишком обычное лекарство, чтобы его выписывали врачи и чтобы стоять из-за них в очереди в поликлинике, представьте себе жизнь без этих лекарств.
Без антибактериальных препаратов произойдет следующее:
- больницы перестанут быть стерильными;
- у женщин после родов легко будет возникать заражение крови или сепсис;
- ни один врач не рискнет провести операцию, диагностическое исследование, особенно у новорожденных;
- нельзя будет пересаживать донорские органы или ставить искусственные протезы;
- очищение крови с помощью диализа станет фактором риска заражения крови;
- после химиотерапии и лучевой терапии рака у больных начнутся инфекционные осложнения;
- снова станут смертельными туберкулез, малярия и другие острые инфекционные болезни;
- инфекция из небольшого очага быстро распространится по всему организму;
- у больных сахарным диабетом резко повысится количество ампутаций и инфекционных осложнений;
- опасно будет даже забирать кровь из вены для анализа:
- мы не сможем питаться мясом животных или птиц без риска заразиться, ведь антибиотики широко используют в сельском хозяйстве.
Когда использовать антибиотики?
Антибиотики могут быть бактериостатическими или бактерицидными. В первом случае они препятствуют размножению бактерий, во втором – они уничтожают живые клетки. При этом антибиотики эффективны только тогда, когда инфекция вызвана бактериями. Поэтому назначение антибиотика должно происходить только тогда, когда врач уверен, что инфекция бактериальная.
К сожалению, тесты, подтверждающие этиологию инфекции, проводятся редко. При назначении антибиотика врачи обычно полагаются на конкретные симптомы бактериальной инфекции и место возникновения инфекции, зная, что определенные группы бактерий вызывают определенные симптомы.
Если у врача есть сомнения относительно происхождения заболевания, он обязан назначить анализ, подразумевающий посев биологической жидкости, например, мокроты, на специальную питательную среду. На таких средах бактерии быстро разрастаются, образуя колонии, хорошо различимые под микроскопом.
Затем можно воздействовать на выявленные бактерии разными антибиотиками, чтобы понять, какой из них будет уничтожать обнаруженный вид бактерий. Такой же анализ необходимо провести, если лечение уже назначенным антибиотиком остается неэффективным.
Устойчивость к тетрациклину
Устойчивость к тетрациклину широко распространена среди бактерий, что, как полагают, связано с расположением гена, определяющего устойчивость к тетрациклину, в той части плазмиды, к-рая контролирует трансмиссибельность (см. Плазмиды).
Объект действия тетрациклина в клетке — рибосомно-матричный комплекс, нарушается его связь с аминоацил-РНК. Однако устойчивость R+-бактерий к тетрациклину не связана с изменениями свойств рибосом; отсутствуют также доказательства существования ферментативной инактивации антибиотика. Резистентность к тетрациклину обусловлена нарушением проникновения антибиотика в клетку. В нормальную клетку тетрациклин проникает с помощью энергетически зависимой транспортной системы, угнетаемой азидом натрия, требующей присутствия ионов магния.
Устойчивость к тетрациклину индуцибельна, т. е. возрастает, если в среде присутствуют суббактериостатические дозы антибиотика или его аналогов .
Уровень устойчивости к тетрациклину у R+-штаммов бактерий, а также эффективность индукции определяются структурой плазмиды, несущей ген tet (контролирует синтез ТЕТ-белка), а также особенностями бактериального хозяина, в к-ром данная плазмида находится. Так, напр., плазмида RP4 определяла в одном и том же штамме более низкую устойчивость к тетрациклину, чем плазмида R6. С другой стороны, степень индукции устойчивости к тетрациклину широко варьировала и оказалась наиболее высокой в Erw. aroideae, несущей плазмиду RP4 (Д. М. Гольдфарб, Н. В. Купцова, 1979). Молекулярный механизм индукции устойчивости бактерии к тетрациклину изучен недостаточно. Было выяснено, что небольшие дозы тетрациклина индуцируют у бактерии синтез нового белка — так наз. ТЕТ-белка. Появление этого белка коррелирует с возникновением устойчивости бактерий к антибиотику . Предполагается, что в норме синтез TET-белка зарепрессирован, и малые дозы тетрациклина выполняют роль антагониста репрессора синтеза ТЕТ-белка. Т. о., регуляция функционирования генов, кодирующих синтез ТЕТ-белка, негативная.
В 1978 г. было установлено , что индукция устойчивости к тетрациклину малыми дозами антибиотика сопровождается синтезом нескольких белков, ассоциированных с мембраной клетки. Эти белки отличаются друг от друга по молекулярному весу (массе), равному 34 000, 26 000, 18 000 и 14 000 дальтон, и все кодируются R-плазмидой. Функция первых двух из этих белков сводится к снижению способности бактерий накапливать антибиотик, функция третьего белка пока не установлена. Аналогичный индуцибельный механизм, обеспечивающий устойчивость к тетрациклину, обнаружен и у St. aureus. Устойчивость бактерии к макролидам, подобно устойчивости к тетрациклинам, не связана с хим. модификацией антибиотика.
Профилактика и борьба
Устойчивость к антибиотикам набирает темпы из-за их неправильного и чрезмерного использования, а также слабой профилактики инфекций и борьбы с ними. Меры к ослаблению последствий устойчивости и ограничению её распространения можно принимать на всех уровнях общества.
Население
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним индивидуумы могут:
- принимать антибиотики только по назначению квалифицированного работника здравоохранения;
- никогда не требовать антибиотиков, если, по словам медработника, в них нет необходимости;
- всегда соблюдать рекомендации медработника при использовании антибиотиков;
- никогда не давать свои антибиотики другим лицам или не использовать оставшиеся антибиотики;
- предотвращать заражение в соответствии с «Пятью важнейших принципов безопасного питания», регулярно моя руки, соблюдая гигиену во время приготовления пищи, избегая тесного контакта с больными, практикуя более безопасный секс и своевременно делая прививки.
Лица, формирующие политику
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним лица, формулирующие политику, могут:
- обеспечить принятие действенного национальный плана действий против устойчивости к антибиотикам;
- улучшать эпиднадзор за устойчивыми к антибиотикам инфекциями;
- усиливать меры политики, программы и осуществление мер профилактики инфекций и борьбы с ними;
- регулировать и поощрять надлежащее использование качественных препаратов и обращение с ними;
- предоставлять информацию о последствиях устойчивости к антибиотикам.
Медработники
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним медработники могут:
- предотвращать инфекции, обеспечивая чистоту своих рук, инструментов и окружающей среды;
- назначать и отпускать антибиотики только в случаях, когда в них есть необходимость, в соответствии с действующими лечебными инструкциями.
- информировать группы по эпиднадзору об инфекциях с устойчивостью к антибиотикам;
- беседуйте с пациентами о том, как правильно принимать антибиотики, об устойчивости к антибиотикам и об опасности их неправильного использования;
- говорите пациентам, как предотвращать инфекции (например, делая прививки, моя руки, практикуя более безопаснй секс и закрывая нос и рот при чихании).
Индустрия здравоохранения
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним индустрия здравоохранения может:
инвестировать средства в научные исследования и разработку новых антибиотиков, вакцин, средств диагностики и других инструментов.
Сельскохозяйственный сектор
Для предотвращения распространения устойчивости к антибиотикам и борьбы с ним сельскохозяйственный сектор может:
- вводить антибиотики в организм животных лишь под ветеринарным надзором;
- не использовать антибиотики для стимулирования роста или профилактики болезней у здоровых животных.
- вакцинировать животных с целью сокращения потребности в антибиотиках и использовать альтернативы антибиотикам, когда они существуют;
- продвигать и применять надлежащую практику на всех этапах производства и переработки пищевых продуктов животного и растительного происхождения;
- повышать биобезопасность на фермах и предотвращать инфекции, улучшая гигиену и благополучие животных.
Резистентность к антибиотикам
Стремительный рост устойчивости бактерий к антибиотикам представляет серьезную угрозу для здоровья и жизни людей. По статистике ВОЗ, вероятность смертельного исхода заболевания у пациента, инфицированного метициллино-резистентными штаммами стафилококка (MRSA ), на 70% выше, чем у больного, инфицированного обычными, чувствительными к антибиотикам штаммами.
Во многих странах наблюдается тенденция к росту резистентности E. Coli (основного возбудителя инфекций мочевыводящих путей) к фторхинолонам и цефалоспоринам. Все чаще регистрируются случаи устойчивости бактерий к препаратам резерва для данной инфекции (карбапенемы для Klebsiella pneumonia, 3-е поколение цефалоспоринов для гонореи) и т.д. То есть, те заболевания, которые на протяжении многих лет эффективно лечились антибактериальными препаратами сегодня, снова представляют опасность для населения.
В некоторых случаях, тест на чувствительность к антибиотикам показывает частичную или полную устойчивость к большинству «классических» для данной инфекции антибиотиков.
Такая неутешительная картина связана с частым нерациональным и необоснованным применением противомикробных средств. Многие пациенты покупают лекарства не по назначению врача, а по рекомендации друзей, фармацевтов в аптеке, после просмотра рекламы или просто вспомнив, что когда-то этот препарат уже помогал. Также, у многих существуют «любимые» лекарства, которые принимаются по несколько дней при первых признаках заболевания.
Важно понимать, что самоназначение антибиотиков, самостоятельная коррекция назначенных дозировок, кратности приема и длительности курса способствует формированию и распространению бактерий с приобретенной устойчивостью к антибиотикам
Как развивается устойчивость к противомикробным препаратам?
Вторичная (приобретенная) резистентность к антибиотикам развивается за счет спонтанных мутаций в геноме микробной клетки после контакта с противомикробным средством
Важной особенностью данных мутаций является их способность «запоминаться» бактериями и передаваться следующим поколения патогенов. Это способствует быстрому распространению устойчивых штаммов в окружающей среде
Степень резистентности (сниженная чувствительность к антибиотикам или полная устойчивость), а также скорость ее развития зависит от видов и штаммов бактерий.
Быстрее всего под действием антибиотиков мутируют:
- стафилококки (грамположительные кокки);
- эшерихии (грамотрицательные бактерии);
- микоплазмы (внутриклеточные возбудители);
- протей (грам- бактерии);
- синегнойная палочка (грамотрицательные бактерии).
Достаточно редко встречаются антибиотикорезистентные стрептококки группы А, клостридии, сибироязвенные и гемофильные палочки.
Среди механизмов формирования устойчивости, на данный момент наиболее важными считают:
- ферментную инактивацию антибиотика;
- модификацию молекул-мишеней в микробной клетке;
- способность возбудителей активно выводить антибиотик (эффлюкс);
- снижение проницаемости микробной мембраны для лекарства.
Поскольку активное выведение и нарушение проницаемости основаны на ограничении доступа антибиотика в бактериальную клетку, их часто объединяют в один механизм резистентности.
Устойчивость к антибиотикам, содержащим бета-лактамное кольцо (к пенициллину, цефалоспорину)
Устойчивость грамположительных бактерий к пенициллину обусловлена способностью бактерий синтезировать фермент, гидролизующий бета-лактамное кольцо, присутствующее в молекуле всех пенициллинов и в цефалоспорине. Этот фермент получил название бета-лактамазы или пенициллиназы.
Как показали исследования Новика (R. Novick, 1963), гены, контролирующие синтез пенициллиназы у Staphylococcus aureus, локализованы на нетрансмиссибельных плазмидах. В отличие от устойчивости к аминогликозидам, устойчивость к пенициллину у грамположительных бактерий, за исключением Вас. cereus, индуцибельна. Индукция синтеза пенициллиназы достигается присутствием в среде низких концентраций метициллина или оксациллина — препаратов, устойчивых к действию пенициллиназы. Напротив, у грамотрицательных бактерий синтез пенициллиназы конститутивен.
Грамотрицательные бактерии обычно менее чувствительны к пенициллину, чем грамположительные. Однако открытие и внедрение в клин, практику карбенициллин, ампициллина, цефалоспорина, активных против грамотрицательных бактерий, привело к быстрому появлению и широкому распространению устойчивых к пенициллину штаммов среди грамотрицательных бактерий и особенно среди энтеробактерий. Как и в случае грамположительных бактерий, у большинства грамотрицательных, выделенных из клин, материала, резистентность к пенициллину определяется присутствием в клетке R-плазмид, контролирующих синтез бета-лактамаз. Установлено, что бета-лактамазы, синтезируемые грамотрицательными бактериями, различны как по своим физ.-хим. свойствам, так и но субстратной специфичности. Существует по крайней мере 8 различных бета-лактамаз, которые по своим свойствам (субстратная специфичность, иммунологическая перекрестная реактивность, молекулярный вес, электрофоретическая подвижность при разных pH, чувствительность к р-меркурбензоату) группируются в четыре основные группы, обозначенные римскими цифрами (I, II, III, IV). Большинство известных R-плазмид контролирует синтез бета-лактамазы III группы. Уровень устойчивости бактерий к пенициллину не всегда является простой функцией количества фермента в бактерии. Он зависит также от таких параметров, как аффинитет фермента к субстрату, от локализации фермента в клетке, скорости проникновения антибиотика и др.
Как справиться с явлением резистентности?
Нужно ли вообще это делать – решать проблему нечувствительности микробов к антибиотикам? Антибиотикорезистентность и пути ее преодоления – что можно предпринять?
Антибиотики необходимы и в качестве профилактики гнойных осложнений при ранениях, хирургических вмешательствах. Поэтому проблема резистентности, несомненно, требует решения и борьбы с этим явлением.
Всегда легче предупредить проблему, чем решать ее
Поэтому большое внимание должно уделяться профилактике возникновения резистентности в микробной популяции. Какие меры можно предпринять для этого?
- отказаться от бесконтрольного приема антибактериальных препаратов – они должны назначаться только специалистом и только по конкретным показаниям;
- использовать только тот антибиотик, который действительно губителен для данного вида бактерий – если принимать препараты из несоответствующей группы, можно сформировать резистентность для других микроорганизмов;
- осуществлять антибактериальное лечение в те сроки, которые указаны специалистом – недостаточный прием препарата приводит к неполноценному уничтожению бактерий в организме человека. Как следствие, формируется носительство той клетки, которая уже знакома с принимаемым антибиотиком, и в следующий раз этот препарат просто не подействует.
Если же резистентность выявилась уже в процессе лечения, справиться с ней можно следующими способами:
- уточнение чувствительности микроба и назначение препарата из той группы, которая оказывает влияние на данный возбудитель;
- сочетание нескольких антибиотиков, каждый из которых обладает своим действием в отношении бактерий;
- биохимическая резистентность решается путем использования защищенных антибактериальных средств. В их состав добавлены вещества, нечувствительные к действию ферментов микроба.
Резистентность к антибактериальным препаратам – одна из основных проблем современной медицины. Много неблагоприятных исходов тяжелых заболеваний связано именно с этим явлением
Так как справляться с уже сформированной устойчивостью достаточно сложно, значит, большое внимание должно уделяться ее профилактике


Поколения и резистентность
Существует 4 поколения антибактериальных медикаментов. Последнее поколение демонстрирует наибольшую эффективность. В структуре противомикробных таблеток или уколов находится множество сложных элементов. Препараты 4 поколения обладают не только большей лекарственной эффективностью, но и менее токсичны для организма.
Средства последнего поколения принимаются меньшее количество раз в день. Эффект от их использования достигается гораздо быстрее. С их помощью возможно вылечить хроническое заболевание. Ингибирование ферментов микроба у современных препаратов очень высокая. При правильных действиях медикаменты последнего поколения будут эффективны несколько десятилетий.
В больницах часто назначают лекарства 3 и 4 поколения. Простые заболевания поддаются терапии при использовании препаратов 3 поколения. Они обладают большей токсичностью, но приобретаются в аптеке по более выгодной цене. Современное поколение не так широко распространенно и имеет стоимость выше, чем у более устаревших аналогов. Прием самого современного лекарства не всегда целесообразен. Пользоваться необходимо тем медикаментом, который оказывает нужный эффект. Если пренебрегать этим правилом, вызывается резистивность к современным лекарствам.

Пока еще микробы не имеют резистентность к антибиотикам последнего поколения. Хотя в условиях больниц и мест скопления различных патогенных микроорганизмов уже ходят слухи о том, что существуют невероятно устойчивые штаммы стафилококков и стрептококков. Со слов ученых антибиотикорезистентность способна развиваться бесконечно. Более того, об этом процессе было известно до появления первого антибиотика. Это глобальная проблема, так как создавать эффективные препараты все сложнее. Резистентность — особенность живых организмов. Это значит, что, в данный момент создать лекарство, к которому не будет привыкания — невозможно. Однако ученые двигаются в сторону изобретения идеального медикамента. Скорее всего, это будет абсолютно новый класс лекарств.
Принципы применения для предотвращения резистентности
От правильных действий человека зависит, как быстро микробы будут развиваться. Если будет вестись беспорядочный прием противомикробных медикаментов, в нужный момент лекарство просто не подействует. Любые антибиотики по механизму своего действия со временем вызывают резистентность.
Выделяют следующие правила приема антибиотиков:
- всегда заканчивать курс, даже если наступило улучшение;
- принимать медикамент по инструкции или рекомендациям врача;
- после приема проводить профилактику дисбактериоза;
- избегать самостоятельного назначения и использования антибактериальных препаратов.
Если соблюдать это, удастся повысить пользу от терапии и снизить частоту возникновения побочных эффектов. Если микробы будут уничтожены, то резистентность не передастся новым микроорганизмам. Стоит понимать, что соблюдение норм приема антибиотиков необходимо, чтобы при столкновении с серьезной болезнью (бактериальная пневмония, менингит) воздействовать на патогенные инфекции и возбудителей.
Правила забора материала для антибиотикограммы
Бактерии вызывают заболевания разных органов и обнаруживаются в разных средах организма — кровь, моча, кал, мокрота. Чтобы получить достоверные результаты, материал для исследования нужно собирать правильно.
Забор крови делает медсестра в процедурном кабинете. Для исследования берется венозная кровь, ее собирают в стерильную пробирку и сразу отправляют в лабораторию.
Мазок из зева и носоглотки берет медсестра или врач. Стерильным тампоном собирают слизь из носовых ходов, с задней стенки глотки. Тампон помещают в стерильную пробирку или сразу на питательную среду.
Влагалищную и шеечную слизь собирает гинеколог. Женщина располагается на гинекологическом кресле, а врач с помощью специального инструмента собирает слизь. Ее помещают в стерильную пробирку и отдают для исследования.
Мочу и кал собирают дома. Перед мочеиспусканием и дефекацией нужно тщательно подмыться. В стерильный контейнер собирают среднюю порцию мочи. Дефекацию рекомендуется совершать в чисто вымытое судно или другую емкость. Оттуда стерильной лопаточкой собрать кал и поместить в стерильный контейнер.
Если у человека острое заболевание, анализы делают до назначения антибактериальной терапии. На фоне даже однократного приема антибиотиков состав патогенной флоры меняется. Если же у человека длительно текущий патологический процесс, плохо поддающийся терапии, то исследование делают даже на фоне приема противомикробных препаратов.
О причинах и механизмах
В настоящее время проблема антибиотикорезистентности в России и в мире становится все масштабнее. Принято выделять генетическую и не являющуюся таковой стойкость патологических форм жизни. Активность бактериальной репликации во многом определяет результативность медикаментозных средств. Неактивные в плане обменных процессов, не размножающиеся бактерии стойки к влиянию лекарственных соединений, а вот потомство будет по-прежнему чувствительным.
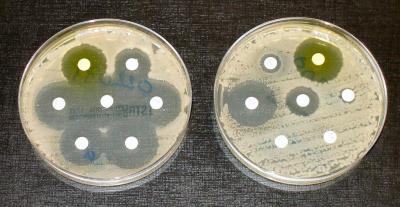
Установлено, что микобактерия, провоцирующая туберкулез, продолжительное время (годы) существует в органических тканях зараженного человека. Весь это период бороться с ней с помощью химиотерапии бесполезно – возбудитель стоек к любым препаратам. А вот в момент, когда иммунитет носителя ослабляется, и микобактерия начинает активно размножаться, ее потомство получает чувствительность к лекарственным средствам.
В некоторых случаях потеря антибиотикорезистентности объясняется утерей специфической мишени. Некоторые чувствительные к пенициллиновому ряду микроскопические формы жизни могут трансформироваться в протопласты при поступлении в микроорганизм антибиотика, вследствие чего утрачивается стенка клетки. В будущем микробы вновь могут приобрести чувствительность к тем препаратам, которые угнетают синтез стенки клетки: при возвращении в родительскую форму процессы синтеза должны возобновиться, что и приводит к преодолению антибиотикорезистентности.
Что такое резистентность?
Резистентность — это устойчивость микроорганизмов к действию антибиотиков. В организме человека в совокупности всех микроорганизмов встречаются устойчивые к действию антибиотика особи, но их количество минимальное. Когда антибиотик начинает действовать, вся популяция клеток гибнет (бактерицидный эффект) или вовсе прекращает свое развитие (бактериостатический эффект). Устойчивые клетки к антибиотикам остаются и начинают активно размножаться. Такая предрасположенность передается по наследству.
В организме человека вырабатывается определенная чувствительность к действию определенного рода антибиотиков, а в некоторых случаях и полная замена звеньев обменных процессов, что дает возможность не реагировать микроорганизмам на действие антибиотика.
Также в некоторых случаях микроорганизмы и сами могут начать вырабатывать вещества, которые нейтрализуют действие вещества. Такой процесс носит название энзиматической инактивации антибиотиков.
Те микроорганизмы, которые имеют резистентность к определенному типу антибиотиков, могут, в свою очередь, иметь устойчивость к подобным классам веществ, схожих по механизму действия.