Бактериоскопия
Содержание:
- Последовательность действий и особенности методики
- Регламентирующие документы
- 39) Простые, специальные и дифференциально-диагностические среды, элективные среды.
- Расшифровка бакпосева
- Микробиологическая диагностика эшерихиозов
- § 3. Основы эпидемического процесса
- Для чего необходимо бактериологическое исследование?
- Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
- Получение изолированных колоний
- Методы окраски образца
- Механизм проведения
Последовательность действий и особенности методики
Для проведения бактериологического исследования необходимо выполнить сбор материала и культивировать его на питательных средах с последующей микроскопией полученных штаммов и проверкой чувствительности к антибиотикам.
Сбор материала
Биоматериалом для исследования могут служить кровь, моча, ликвор, мокрота, сперма, кал, мазки из глотки, влагалища, уретры, любые другие ткани и жидкости из области инфекционного процесса. Образцы собирают в асептических условиях, помещают в стерильную посуду и в течение 2-х часов доставляют в лабораторию. При необходимости пробы хранят при пониженных температурах.
Культивирование
Культивирование проводят с применением механических или биологических методов. Механический подход с использованием стандартных искусственных сред – наиболее распространенный. В данном случае для высевания образцов используют жидкие и твердые питательные составы. Наиболее распространенные – агар, мясо-пептонный бульон.
Посев материала производят с помощью специальной петли или пастеровской пипетки, растирая полученный образец по поверхности или вводя его в толщу питательной среды. Выделение бактерий производят из чистых культур, которые получают повторным посевом ранее выращенных колоний на новую среду.
Биологические методы подразумевают использование специальных питательных сред, которые учитывают особенности микроорганизма, в частности, чувствительность к некоторым химическим веществам, в том числе антибиотикам. В некоторых случаях применяют метод заражения лабораторных животных или тканевых культур с отслеживанием патологических изменений. Такой подход актуален при крайне незначительном накоплении микроба в тканях человека – в этом случае его выделение посевом на питательных средах не дает результата.
Микроскопическое исследование
Основной метод бактериологической диагностики – бактериоскопия. Она подразумевает визуальную оценку параметров микроорганизма под микроскопом. Для этого используют фиксированные и нефиксированные препараты.
Нефиксированные препараты позволяют исследовать живые образцы бактерий. Основные методы:
- раздавленная капля – образец придавливают между предметным и покровным стеклами;
- висячая капля – образец помещают в лунку на предметном стекле и герметично накрывают покровным.В качестве среды используют изотонический раствор или расплавленный агар. Методика позволяет наблюдать за живыми микроорганизмами в течение нескольких дней.
Фиксированные препараты используют для окрашивания с подробным изучением морфологических и некоторых биохимических параметров патогенов. Каплю бактериального состава размазывают по предметному стеклу и фиксируют пламенем горелки или специальными химическими составами.
Для определения свойств бактериальных препаратов используют ряд общих и специфических методик:
- микроскопия – определение формы, размеров, окрашивания по Граму;
- биохимические методы – исследование ферментативной способности микроорганизма к расщеплению тех или иных углеводов, аминокислот, метаболитов, в том числе способность к гемолизу, фибринолизу при попадании в кровь живых существ;
- серологические методы идентификации – реакции агглютинации под воздействием специфической сыворотки и другие антигенные свойства;
- биологические методы – заражение лабораторных ждивотных с проверкой патогенности и токсигенности взятых образцов, их устойчивости к антибиотикам.
Только совокупный анализ результатов всех методов диагностики – микроскопических, биохимических, серологических, биологических – дает объективный результат для вынесения точного диагноза.
Регламентирующие документы
Исследование воды на наличие микроорганизмов регламентируется ГОСТами и СанПиНами. Основным документом является ГОСТ 18963-73. В нем зафиксированы способы бактериологического анализа воды, которая используется для питья.
В этом документе прописаны:
- способы отбора проб воды для исследования;
- правила их хранения;
- правила перевозки в лаборатории.
Также в ГОСТе прописана применяемая при теста аппаратура. Указаны используемые реактивы вместе с питательными средами. Подробно прописана подготовка к исследованию, сама процедура анализа.
- Применяется и ГОСТ 24849-2014. В этом стандарте прописаны методики бактериологического исследования воды в полевых условиях.
- Некоторые положения касательно анализа воды на наличие микроорганизмов зафиксированы в ГОСТе Р 51232-98. Там прописаны способы бактериологического исследования воды для питьевых нужд.
- В СанПиН 2.1.4 1074 01 зафиксированы требования касательно качества воды, идущей на питьевые нужды. В документе содержатся нормативы по бактериологическому составу питьевой воды, согласно которым она может считаться безопасной.
39) Простые, специальные и дифференциально-диагностические среды, элективные среды.
Простые
(универсальные среды) –ПВ, МПБ, МПА, МПЖ,
молоко. Эти среды для многих неприхотлив.
м/о. Также служат основой для специальных
сред.
Спец-ые
для избирательного культивирования
опред-х видов, изуч. св-в и хранения: 1)
Спец.
обогащенные – для
не размножающихся на простых. Содер.
необх-ые пит. в-ва и ростов-е доб-ки. Для
микобактерий – яичные среды Петраньяни,
для анаэробов – Китта-Тароцци,
сахарно-кровян. агар Ц., для стрептококк
– глюкозо-сывор-й бульон и агар.
2)Элективные
– избирательного роста. Хорошо растут
одни, и плохо др. Оптим. для вида состав
пит. в-в и бактериостат-е доб-ки (анилин.
краски, а/б, желчные соли.) Среда Петраньяни
для тубер-ых содер-ит малахит-й зеленый,
среда Кесслера для кишечн. пал. – бычью
желчь и генцианвиолет, Среда Эндо для
энтеробак – основ. фуксин и сульфит
натрия. Низко- и высоко-селективные. 3)
Дифференциально-диагност.
– для дифферен-ии м/о по культур-ым и
биохим-им св-ам. В состав включают
субстрат (по котор. дифф-ют) и индикатор.
М/о ферментируют субстрат, накапл-ют
продукты расщепления, окрашивая среду
и колонии в цвет индикатора. Жидкие
(среда Гисса, молоко с метиленовым
синим), полужидкие (полужид. агар с индик.
ВР), плотные (Эндо, Левина, ВСА)
4)Комбинированные
несколько субстратов и индикаторов
(трехсахар-й агар Олькеницкого) –
одновр-я диффер-я по ряду признаков.
Расшифровка бакпосева
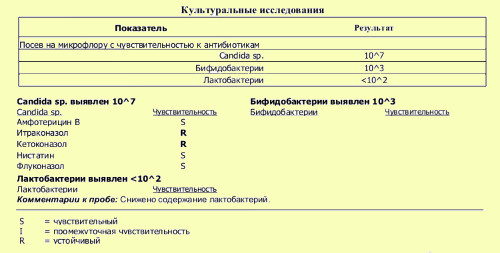
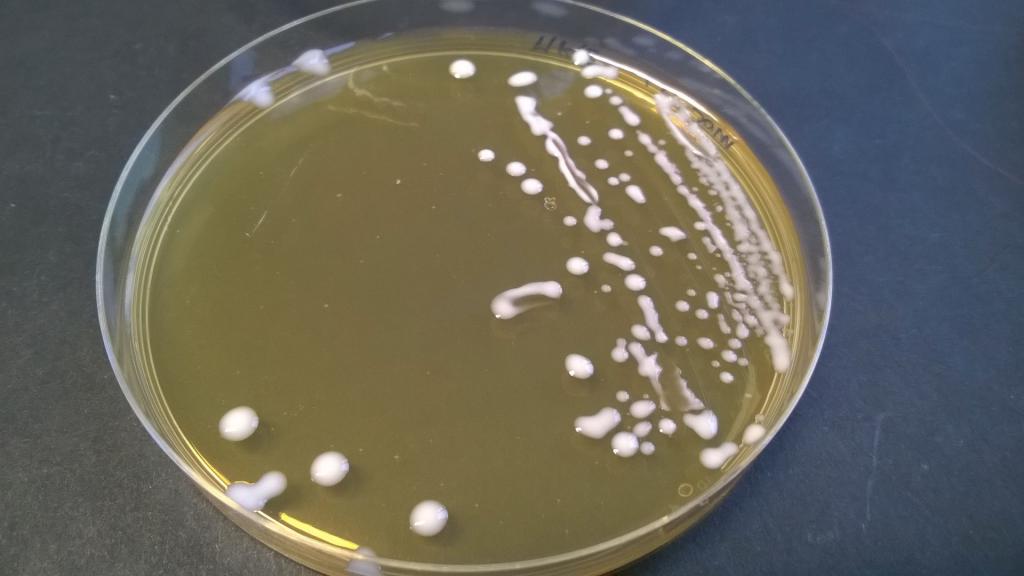
Результат анализа оценивается по нескольким показателям, учитывающим не только качественный фактор (подтверждение наличия бактерий-возбудителей в среде), но и количественный — то есть, степень концентрации патогенных микроорганизмов в исследуемом материале. Для подсчета количества микробных клеток используется понятие колониеобразующей единицы (КОЕ), по которому можно определить уровень насыщенности бактериями изучаемого образца.
Выделяют 4 степени роста возбудителей:
- Первая — скудный рост бактерий на жидкой питательной среде и отсутствие роста на твердой среде. Такой результат не считается отклонением от нормы.
- Вторая — рост бактерий на твердой среде до 10 колоний. Свидетельствует не о наличии болезни, а скорее о загрязненности лабораторных принадлежностей для исследования.
- Третья — рост бактерий на твердой среде в пределах 10-100 колоний.
- Четвертая — более 100 колоний.
В заключении, выдаваемом на руки пациенту, результаты бакпосева обозначаются следующим образом:
- указывается название выявленного возбудителя на латинском языке (например, Trichomonas vaginalis — трихомонада);
- прописывается концентрация микроорганизма, выращенного в условиях питательной среды (норма — до 103 КОЕ/мл, ненорма — от 105 КОЕ/мл);
- указывается характер среды: флора условно-патогенна, патогенная.

Одновременно с определением концентрации бактерий производится анализ их чувствительности к антибиотикам. Наличие положительной реакции на тот или иной антибактериальный препарат обозначается символом «S», отрицательной — «R».
Микробиологическая диагностика эшерихиозов
Цель. Изучить
классификацию и особенности патогенеза
эшерихиозов. Овладеть методами оценки
результатов лабораторного исследования
для подтверждения диагнозов эшерихиозов.
Научиться практически решать вопросы
по использованию эубиотиков для коррекции
микрофлоры кишечника.
Теоретическая
справка
Кишечная
палочка была впервые выделена из
кишечника ребенка и определена как
бактерия–коменсал. Установлено, что
она может вызывать аутоинфекции на
фоне снижения резистентности
макроорганизма. По мере совершенствования
бактериологических методов диагностики
были выделены патогенные варианты E.coli, попадающие в организм
фекально-оральным путем. Наиболее
восприимчивы к этим инфекциям
новорожденные, так как через плаценту
не проходятIgM,IgA,
обусловливающих защиту при кишечных
инфекциях. В женском грудном молоке эти
иммуноглобулины содержатся в титрах
1:8-1:128. в течение 12-18 месяцев ребенок
получающий грудное молоко, более устойчив
к этим инфекциям.
Патогенные
варианты E.coliделятся на пять категорий по О-антигену:
1.Энтеропатогенные
(ЭПКП): 0111, 055, 0126.
2.Энтероинвазивные
(ЭИКП): 0152, 0124, 0144.
3.Этеротоксигенные
(ЭТКП): 0128, 085, 0148.
4.Энтерогеморрагические
(ЭГКП): 0157, 026, 0145.
5.Энтероадгезивные
(ЭАГКП) (структурная основа пока
неизвестна).
В лабораторной
диагностике эшерихиозов используется
первый принцип диагностики: обнаружение
возбудителя – метод бактериологиеский.
Выбор
исследуемого материала — испражнений
– определен локализацией патологического
процесса в кишечнике. Посев производят
на среду Левина или на среду ЭНДО –
темно-красные колонии с металлическим
блеском. Для выявления патогенных
вариантов кишечных палочек учитывают
антигенное строение этих микроорганизмов:
О-, К- и Н-антигены. Агглютинация с
ОК-сывороткой материала из колонии
позволяет определить наличие О-антигена,
свидетельствующего о патогенном варианте
этих бактерий. В то же время антиген
К(В) обусловливает О-инаглютинабельность
микроорганизмов, а о серогруппе эшерихий
судят по О-антигенам. Разрушение
термолабильных К- и Н-антигенов позволяет
определить принадлежность выделенных
бактерий к той или иной серогруппе.
§ 3. Основы эпидемического процесса
Эпидемический процесс — это
возникновение и распространение инфекций
среди населения. Для возникновения и
непрерывного течения эпидемического
процесса необходимо взаимодействие
трех факторов: источника возбудителей
инфекции, механизма передачи инфекции
и восприимчивого населения. Выключение
любого из этих звеньев приводит к
прерыванию эпидемического процесса.
Биологической основой эпидемического
процесса служит паразитарная система,
т. е. взаимодействие паразита и хозяина.
Возбудители инфекционных болезней
делятся по характеристике источников:
АНТРОПОНОЗЫ
ЗООНОЗЫ
Под механизмом передачи
подразумевают способ перемещения
возбудителя инфекционных заболеваний
из зараженного организма в восприимчивый.
Этот механизм включает смену
трех фаз:
выведение микроорганизма из организма
хозяина в окружающую среду;
нахождение возбудителя в окружающей
среде и
внедрение возбудителя в восприимчивый
организм.
Механизмы передачи подразделяются
на:
фекально-оральный,
аэрогенный (воздушно-капельный),
кровяной (трансмиссивный),
контактный,
вертикальный (от матери плоду через
плаценту).
По механизму передачи и была предложена
Л.В. Громашевским классификация
инфекционных болезней (см. выше).
Следующим элементом эпидемического
процесса является восприимчивость
населения.
Если иммунная «прослойка»
населения высокая, то можно считать,
что достигается состояние эпидемического
благополучия и циркуляция возбудителя
прекращается. И наоборот, при снижении
иммунной прослойки населения увеличиваются
те или иные инфекционные заболевания.
Так, например, в 90-е гг. в России снизилась
иммунная «прослойка» населения к
дифтерии, что привело к резкому увеличению
дифтерийных больных. Поэтому задачей
эпидемиологов является создание в
коллективах этой «прослойки» путем
проведения массовой вакцинации против
соответствующих возбудителей. В последние
годы широко применяется противогриппозная
вакцинация, что в общем привело к снижению
заболеваемости гриппом. Интенсивность
эпидемического процесса выражается в
показателях заболеваемости и смертности
на 10 тыс. или 100 тыс. населения.
Эпидемиологи различают три
степени интенсивности эпидемического
процесса:
Спорадическая заболеваемость — это
обычный уровень заболеваемости данной
нозологической единицы на одной
территории в данный момент времени.
Эпидемия— распространение инфекционных
болезней среди населения села, города
или области.
Пандемия — распространение инфекционных
заболеваний среди населения разных
стран и континентов. Например, пандемия
чумы в прошлом столетии или распространение
ВИЧ-инфекции в XX в.
В соответствии с распространенностью
С.В. Прозоровский разделил инфекционные
заболевания на:
1) кризисные инфекции — инфекции,
угрожающие существованию человеческой
популяции (ВИЧ-инфекция);
2) массовые — вызывающие свыше 100
заболеваний на 100 000 населения. Первое
место здесь занимают грипп и ОРВИ, на
долю которых приходится ежегодно 92,5%
всех случаев инфекционной заболеваемости;
3) распространенные управляемые — от
20 до 100 случаев заболевания на 100 тыс.
населения. К таким заболеваниям относятся
те инфекции, против которых осуществляется
вакцинация населения — это дифтерия,
столбняк, бруцеллез, коклюш. Хотя,
несмотря на наличие профилактических
препаратов, нельзя сказать, что все
обстоит благополучно. Так, среди привитых
против дифтерии заболевание составляет
57%;
4) распространенные неуправляемые —
заболеваемость менее 20 случаев на 100
тыс. населения. Это группа инфекций,
требующих постоянного внимания в плане
научных исследований. Это относится к
менингококковой инфекции, лептоспирозам,
цитомегаловирусной инфекции и др.;
5) спорадические — единичные случаи
заболеваемости на 100 тыс. населения
(бешенство, сыпной тиф).
Для чего необходимо бактериологическое исследование?
Бактериологические исследования позволяют идентифицировать возбудителя болезни и установить его степень чувствительности к определенным антибиотикам для выявления эффективности лечения. Данный метод исследования широко применяется в медицинской практике инфекционистами, отоларингологами, гинекологами, урологами, онкологами, хирургами и другими специалистами. Он назначается при любых воспалительных заболеваниях в организме и при подозрении на развитие сепсиса.
Как правильно осуществить забор материала?
Материалом для бактериологических исследований может служить кровь, ликвор, мокрота, испражнения, моча, желчь, спинномозговая жидкость, грудное молоко, выделения из ротовой полости, половых органов, зева, носоглотки и ран.
Главное требование забора – стерильность посуды и инструментов. При несоблюдении этого требования результаты окажутся совершенно неправильными, так как произойдет обсеменение собранного материала.
Брать биологический материал для исследований следует до начала приема антибиотиков. В противном случае результат существенно исказится.
Полученный материал необходимо немедленно доставить в лабораторию, чтобы не допустить его гибели.
В нашей лаборатории забор биологических жидкостей выполняется в абсолютно стерильных условиях специально обученными медсестрами в соответствии со всеми правилами, что гарантирует качество собранного материала и достоверность полученных результатов.
Как проходит исследование?
Бактериологические исследования включают несколько этапов, на проведение которых требуется от 3 до 10 дней.
Чтобы выделить чистую культуру возбудителя, осуществляют посев полученного материала на специальную питательную среду, на которой способен жить только определенный вид микроорганизмов. Например, для идентификации дифтерийной палочки применяют теллуритовую среду, а для обнаружения кишечной палочки – среду Эндо. Если требуется выделить условно-патогенные микроорганизмы, то пользуются универсальными питательными средами, чаще всего кровяным агаром.
Питательную среду помещают в термостат, чтобы создать оптимальные условия для роста и размножения микроорганизмов.
По истечении определенного времени производят контрольный осмотр полученных колоний
Если необходимо, используют специальные красители, позволяющие обнаружить определенные штаммы бактерий.
При контрольном осмотре обращают внимание на цвет, форму и плотность колонии, ее способность к разложению некоторых органических и неорганических соединений. Затем с помощью специальных методов подсчитывают количество микроорганизмов в образце.
Плюсы и минусы бактериологического исследования
Бактериологический посев имеет несколько преимуществ:
- характеризуется высокой специфичностью;
- позволяет проводить исследование любой биологической жидкости;
- дает возможность определить чувствительность патогенного микроорганизма к определенному лекарству и правильно подобрать терапию.
Но есть у этого метода и некоторые недостатки:
- результат можно получить только по происшествии нескольких дней;
- требует высокой квалификации персонала бактериологической лаборатории;
- предъявляет высокие требования к забору материала.
Результат исследования
Результатом бактериологического исследования является обнаружение возбудителя (или его отсутствие) в собранном материале и выявление его концентрации, что позволяет подобрать результативную терапию и эффективно избавиться от возбудителей.
Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
Требования:
среды должны быть питательными
должны иметь определенные ph
должны быть изотоническими, т.е.
осмотическое давление в среде должго
быть такое же как в клетке.
должны быть влажными и не слишком
жидкими
должны облпдпть определенным
окислительно-восстановительным
потенциалом
должны быть стерильными
должны быть унифицированными, т.е.
содержать постоянные количества
отдельных ингредиентов.
Питательные среды можно разделить:
А) По происхождению:
1} естественные — натуральные продукты
питания (мясо, молоко, картофель);
2) искусственные — приготовленные
специально для выращивания микробов:
— среды из естественных продуктов (мясная
вода, мясопептонный бульон (МПБ),
мясопептонный агар (МПА), — не имеющие
постоянного состава; — синтетические
питательные среды — растворы строго
определенных количеств солей, аминокислот,
азотистых оснований, витаминов в
дистиллированной воде — имеют постоянный
состав, используются для выращивания
микроорганизмов и культур клеток при
получении вакцин, иммунных сывороток
и антибиотиков;
Б) По назначению:
1) общего назначения (МПБ, МПА) — на них
растет большинство микробов;
2) элективные — избирательно способствуют
росту одного вида микробов из смеси
(например, желточно-солевой агар для
стафилококков);
3) дифференциально-диагностические —
позволяют отдифференцировать по внешнему
виду среды один вид микроба от других
(например среды Эндо, Левина для кишечной
группы микробов).
Кроме того, в зависимости от целей
использования
в схеме выделения
чистых культур, по назначению можно
выделить следующие среды:
1) обогащения — подавляют рост микробов,
сопутствующих возбудителю;
2) для получения изолированных колоний;
3) накопления чистой культуры;
В) По консистенции:
1) жидкие;
2) полужидкие (при добавлении агар-агара
в концентрации 0,5-0,7%);
3) плотные — выше 1%.
Получение изолированных колоний
1. Метод Дригальского. Он заключается в том, что на бактериальную петлю наносится мазок с различными видами микроорганизмов. Этой петлей проводят по первой чашке Петри с питательной средой. Далее, не меняя петлю, методом остаточного материала проводят по второй и третьей чашкам Петри. Так, на последних образцах колонии бактерии будут засеваться не слишком плотно, тем самым упрощается возможность найти необходимые для работы бактерии.
2. Метод Коха. В нем используются пробирки с расплавленной питательной средой. Туда помещается петля или пипетка с мазком бактерий, после чего содержимое пробирки выливается на специальную пластинку. Агар (или желатин) застывает через какое-то время, а в его толще легко обнаружить нужные колонии клеток
Важно перед началом работы развести смесь бактерий в пробирках, чтобы концентрация микроорганизмов не была очень большой
Этапы которого основаны на выделении нужной культуры бактерий, не обходится без этих двух способов нахождения изолированных колоний.
Методы окраски образца
Окрашивание может быть простым, с использованием одного красителя. И сложным, при котором с целью точной дифференциации клеток бактерий по тем или иным их характерным признакам последовательно наносятся на образец несколько различных окрашивающих химических реагентов. Примером сложного окрашивания может служить методы Грама и Циля-Нильсена.
Метод Грама
Метод Грама позволяет определить химический состав клеточной мембраны. Благодаря этому методу была введена классификация бактерий по Граму: грамположительные бактерии (к которым относятся возбудители многих болезней) после окраски приобретают темно-фиолетовый цвет, а грамотрицательные – характерный красный оттенок. Метод Грама состоит из следующих этапов:
- Сначала препарат обрабатывают раствором Люголя на протяжении одной минуты.
- После обработки люголем образец обесцвечивают с помощью спирта.
- Затем препарат промывают дистиллированной водой и дополнительно окрашивают фуксином.
Метод Циля-Нильсена
Метод Циля-Нильсена применяется для определения кислоточувствительных бактерий, в клеточных мембранах которых содержится большое количество липидов, к примеру, возбудителей туберкулеза. Работа по данному методу проводится в пять этапов:
- На предметное стекло накладывают фильтровальную бумагу, на которую затем наносят небольшое количество фуксина Циля.
- Затем предметное стекло нагревают до появления характерного пара. После появления пара стеклу дают остыть. Данную процедуру повторяют еще два раза, после чего снова дают остыть стеклу.
- После этого дистиллированной водой смывают фуксин с приборного стекла, предварительно убрав бумагу.
- Затем стекло помещают в раствор соляной или серной кислоты до полной утраты образцом цвета.
- Наконец, на обесцвеченный препарат наносят раствор метиленового синего, стекло промывают дистиллированной водой и дают ему высохнуть для дальнейшего рассмотрения получившегося препарата под микроскопом.
Метод Леффлера
В число простых методов окрашивания входит метод Леффлера. При нем все бактерии приобретают синий цвет. Работа по данному методу проводится в два шага:
- На мазок кладется фильтровальная бумага, на которую наносится раствор метиленового синего Леффлера. В таком состоянии препарат оставляется на 3-5 минут.
- По прошествии данного промежутка времени препарат промывается водой и высушивается, после чего его можно исследовать под микроскопом.
Механизм проведения
Процедуру лабораторного исследования условно можно разделить на несколько этапов:
- Забор материала и помещение его на специальные питательные среды. Тип используемой среды зависит от цели проведения бакпосева (выращивание одного определенного возбудителя или расшифровка бактериальных культур с целью дальнейшего построения антибиотикограммы). При необходимости жидкие среды могут заменяться впоследствии на твердые поверхности, что позволяет проводить более точную идентификацию колоний бактерий.
- Помещение питательной среды в специальное оборудование (термостат), где создаются соответствующие условия для роста и размножения патогенных возбудителей. Имеют значение показатели влажности воздуха, температуры, освещения и т. д.
- Подкрашивание материала различными реагентами для лучшего осмотра и дальнейшего анализа. За счет красителей бактерии меняют свою расцветку и становятся более заметными на общем фоне питательной среды.
- Оценка выросших колоний по определенным показателям: плотность, форма, расцветка, химический состав и т. д.
В данном видео, на примере бактериологического анализа мочи, рассказывается о принципе проведения бакпосева.