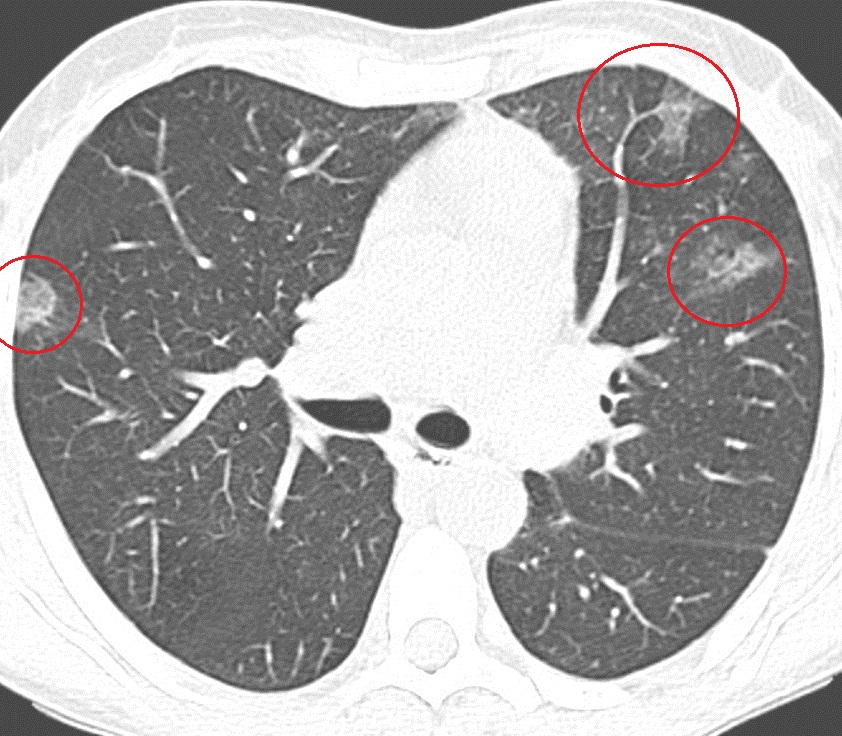
Бактериологическое исследование
Содержание:
- Воздух
- Бизнес и финансы
- Для определения каких микроорганизмов чаще всего проводятся бактериальные посевы
- Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
- Оборудование для микробиологического контроля качества продуктов
- Санитарно-микробиологическое исследование мяса и мясных продуктов. Критерии микробиологической безопасности
- Седиментация
- Регламентирующие документы
- Современные методы бактериологического исследования
- Получение изолированных колоний
- Последовательность действий и особенности методики
- Забор и транспортировка
- 2.1. Понятие о санитарно-показательных микроорганизмах
- Микробиологический контроль объектов I группы
- Бактериоскопический метод исследования
- Методы и цели микробиологии
- Приказ 535 «Об унификации микробиологических методов исследования»
- Методы микробиологической диагностики
- Введение
Воздух
Он считается транзитной средой для микроорганизмов. Основными методами микробиологического исследования воздуха являются седиментация (оседание) и аспирация.
Микрофлора воздушной среды условно разделяется на переменную и постоянную. К первой относятся дрожжи, пигментообразующие кокки, спороносные бациллы, палочки и прочие микроорганизмы, устойчивые к высыханию, воздействию света. Представители переменной микрофлоры, проникая в воздух из привычной для них среды обитания, недолго сохраняют свою жизнеспособность.
В воздухе крупных мегаполисов микроорганизмов намного больше, чем в воздушной среде сельской местности. Над морями, лесами бактерий очень мало. Очищению воздуха способствуют осадки: снег и дождь. В закрытых помещениях микробов намного больше, чем на открытых пространствах. Их количество повышается в зимний период при отсутствии регулярного проветривания.
Бизнес и финансы
БанкиБогатство и благосостояниеКоррупция(Преступность)МаркетингМенеджментИнвестицииЦенные бумагиУправлениеОткрытые акционерные обществаПроектыДокументыЦенные бумаги — контрольЦенные бумаги — оценкиОблигацииДолгиВалютаНедвижимость(Аренда)ПрофессииРаботаТорговляУслугиФинансыСтрахованиеБюджетФинансовые услугиКредитыКомпанииГосударственные предприятияЭкономикаМакроэкономикаМикроэкономикаНалогиАудитМеталлургияНефтьСельское хозяйствоЭнергетикаАрхитектураИнтерьерПолы и перекрытияПроцесс строительстваСтроительные материалыТеплоизоляцияЭкстерьерОрганизация и управление производством
Для определения каких микроорганизмов чаще всего проводятся бактериальные посевы
- Разнообразной кокковой флоры, вызывающей гнойное поражение половых путей, органов дыхания, ЛОР-органов, нагноения ран и язв.
- Дифтерийной палочки – возбудителя опасной болезни – дифтерии, поражающей дыхательные пути, глаза, нос.
- Возбудителей кишечных инфекций – кишечную палочку, дизентерийную группу, брюшнотифозные бактерии, возбудителей паратифа, сальмонеллу, иерсинию.
- Разнообразных микробов, вызывающих урогенитальные патологии и половые инфекции – гонококк, микоплазму, уреаплазму, трихомонаду, грибок молочницы.
- Кроме того, высевают возбудителей, которые могут вызывать различные заболевания – энтеробактерии, гемофильные микроорганизмы, клебсиеллы.
Питательные среды для аэробов и анаэробов. Требования, предъявляемые к питательным средам, классификация.
Требования:
среды должны быть питательными
должны иметь определенные ph
должны быть изотоническими, т.е.
осмотическое давление в среде должго
быть такое же как в клетке.
должны быть влажными и не слишком
жидкими
должны облпдпть определенным
окислительно-восстановительным
потенциалом
должны быть стерильными
должны быть унифицированными, т.е.
содержать постоянные количества
отдельных ингредиентов.
Питательные среды можно разделить:
А) По происхождению:
1} естественные — натуральные продукты
питания (мясо, молоко, картофель);
2) искусственные — приготовленные
специально для выращивания микробов:
— среды из естественных продуктов (мясная
вода, мясопептонный бульон (МПБ),
мясопептонный агар (МПА), — не имеющие
постоянного состава; — синтетические
питательные среды — растворы строго
определенных количеств солей, аминокислот,
азотистых оснований, витаминов в
дистиллированной воде — имеют постоянный
состав, используются для выращивания
микроорганизмов и культур клеток при
получении вакцин, иммунных сывороток
и антибиотиков;
Б) По назначению:
1) общего назначения (МПБ, МПА) — на них
растет большинство микробов;
2) элективные — избирательно способствуют
росту одного вида микробов из смеси
(например, желточно-солевой агар для
стафилококков);
3) дифференциально-диагностические —
позволяют отдифференцировать по внешнему
виду среды один вид микроба от других
(например среды Эндо, Левина для кишечной
группы микробов).
Кроме того, в зависимости от целей
использования
в схеме выделения
чистых культур, по назначению можно
выделить следующие среды:
1) обогащения — подавляют рост микробов,
сопутствующих возбудителю;
2) для получения изолированных колоний;
3) накопления чистой культуры;
В) По консистенции:
1) жидкие;
2) полужидкие (при добавлении агар-агара
в концентрации 0,5-0,7%);
3) плотные — выше 1%.
Оборудование для микробиологического контроля качества продуктов
При осуществлении микробиологических исследований используют следующее оборудование:
- Ламинарный бокс (для очищения воздуха от пыли и других микрочастиц);
- Аналитические и лабораторные весы;
- Гомогенизаторы (для измельчения исследуемых масс);
- рН-метр;
- Автоклав (для стерилизации инвентаря и обеззараживания отходов);
- Термостат (для поддержания необходимого температурного режима в помещении);
- Холодильная камера (для хранения исследуемых организмов, реактивов и пр.);
- Водяная баня (для поддержания температурного режима и влажности);
- Сушильный шкаф;
- СО2-инкубатор (для исключения возможности появления новых микроорганизмов);
- Дистиллятор (для очистки воды);
- Микроскоп;
- Фильтрационная установка;
- Аспиратор (для забора воздушных масс);
- Вспомогательные инструменты (лабораторная посуда, дозаторы, мешалки и пр.).
Микробиологический контроль качества в продуктах – необходимая и неотъемлемая часть жизни человека. Без качественного, профессионального оборудования невозможно успешное проведение исследований и получение точных результатов. Компания «БиоВитрум» является ведущим производителем и поставщиком микробиологических приборов и необходимых компонентов и гарантирует надежность и качество своей продукции.
Ознакомиться с ассортиментом оборудования для микробиологии Вы можете здесь >>>.
Санитарно-микробиологическое исследование мяса и мясных продуктов. Критерии микробиологической безопасности
При микроскопическом
исследовании мяса определяют количество
бактерий в мазках-отпечатках, которые
готовят из кусочков мяса. Мазки
окрашивают по Граму и микроскопируют.
Мясо считается свежим, если в поле зрения
обнаружено не более 10 бактериальных
клеток.
Бактериологическое
исследование мясных продуктов:
определяют микробное число, а также
устанавливают присутствие БГКП,
сальмонелл, бактерий рода Proteus,
стафилококков и клостридий.
Для
определения общего
количества микроорганизмов
в 1 г продукта делают посев 0,1 и 0,01 г
продукта на питательный агар, инкубируют
48ч и подсчитывают число колоний.
Для определения
БГКП в 1 г продукта производят
посев 5 мл взвеси на элективно —
дифференциальную среду для БГКП и
содержит питательный. При росте
лактозоположительных БГКП синий цвет
меняется на темно-зеленый или
ярко-желтый.
Седиментация
Этот метод микробиологического исследования в микробиологии считается простейшим. Он основывается на оседании капель и частиц на поверхности агара в открытой чашке Петри под действием силы тяжести. Метод седиментации не позволяет точно определить число бактерий в воздухе. Дело в том, что на открытой чашке уловить мелкие фракции пылевых частиц и бактериальных капель довольно сложно. На поверхности задерживаются преимущественно крупные частицы.
Этот метод не используется при анализе атмосферного воздуха. Этой среде свойственны большие колебания скорости движения воздушных потоков. Седиментация, однако, может использоваться при отсутствии более совершенных приборов или источника электроэнергии.
Определение микробного числа осуществляется по методу Омелянского. В соответствии с ним, за 5 минут на поверхности агара площадью 100 кв. см оседает такое число бактерий, которое присутствует в 10 л воздуха.
Регламентирующие документы
Чтобы анализ соответствовал требованиям государства, его регламентируют законы, указанные в таблице:
| Нормативный акт | |
| СанПиН 2.1.4.559-96 | Требования для питьевой воды, централизованных систем подачи водоснабжения. Прописывают правила поддержания контроля качества |
| СанПиН 2.1.4. 1074-01 | Нормативы содержания патогенных микроорганизмов для разных источников воды |
| Санитарные правила 1.2.731-99 | Правила работы с патогенными бактериями 3, 4 группы, гельминтами |
| ГОСТ 18963-73 | Прописаны методы микробиологического анализа питьевой воды |
| ГОСТ 25151-82, 27065-86 | Описаны стандарты качества различных вод и водоснабжения |
Современные методы бактериологического исследования
Все бактериологические исследования можно разделить на две группы в зависимости от того, каков предполагаемый результат.
I. Исследуемый объект должен быть стерилен.
В такой ситуации обнаружение любого микроорганизма является поводом для серьезного беспокойства. О чем идет речь? О крови, моче, материнском молоке, спинномозговой жидкости. Принципиально другой вопрос состоит в том, что взять для бактериологического исследования мочу или молоко и не нарушить при этом стерильности — очень сложно и практически невозможно в амбулаторных условиях. Неудивительно, что к положительным результатам, когда в моче или молоке обнаруживается некая бактерия, врачи часто относятся с определенной (весьма значительной) долей скепсиса. Никогда не бывает стопроцентной уверенности в том, что этот микроб действительно живет в молоке, а не попал туда с поверхности кожи, действительно живет в моче, а не на слизистой оболочке мочеиспускательного канала.
II. Для исследования берется заведомо нестерильный материал.
Всегда, когда изучается нечто, находящееся в контакте с окружающей средой, это нечто содержит бактерии. Любые мазки со слизистых оболочек, любые современные исследования слизи, мокроты, кала в обязательном порядке заканчиваются тем, что будет найдено определенное количество самых разнообразных микробов. Обнаруженные микробы по-разному взаимодействуют с человеческим организмом. Это позволяет выделить три группы бактерий:
1.
Бактерии нормальные, мирные, безвредные или даже полезные, являющиеся естественными обитателями исследуемой среды;
2.
Бактерии опасные, с большой долей вероятности способные вызвать болезнь — патогенные. Их обнаружение — тревожный сигнал, повод к углубленному обследованию, лечению;
3.
Бактерии условно-патогенные — бактерии, мирно сосуществующие с организмом человека, но потенциально опасные, способные вызвать болезнь при определенных обстоятельствах, которые в большинстве случаев возникают тогда, когда ослабевает иммунная защита организма ребенка.
Алгоритм бактериологического исследования
Узнать имя микроба — это далеко не все, хотя и очень важно. Ведь обнаружить некую бактерию — например, в мазке из носа золотистый стафилококк — вовсе не значит доказать, что именно он является причиной насморка: вполне возможно, что стафилококк живет себе мирно в носоглотке, а насморк вирусный или аллергический
Как же разобраться?
Во-первых, понимать, что любые бактериологические исследования — это дополнительная диагностика, а основная диагностика — это реальные жалобы и симптомы.
Во-вторых, следует знать, что современные культуральные методы бактериологической диагностики позволяют не только обнаружить микроб, но и определить, какое количество бактерий присутствует во взятом для исследования материале. В результате мы получим из лаборатории бланк бактериологического исследования, в котором увидим не только имя бактерии, но и ее концентрацию. Выглядит это примерно так: «Обнаружен S. aureus 106», что означает: обнаружен золотистый стафилококк в концентрации 106 микробных клеток на миллилитр (м.к./мл).
Выявив рост бактерий, можно ответить на вопрос, к каким антибактериальным средствам (антибиотикам) они (бактерии) чувствительны. Для этого в питательную среду добавляют различные современные препараты и оценивают, прекращается ли размножение микробов. Прекращается — значит, бактерия чувствительна к данному антибиотику, не прекращается — устойчива.
Получение изолированных колоний
1. Метод Дригальского. Он заключается в том, что на бактериальную петлю наносится мазок с различными видами микроорганизмов. Этой петлей проводят по первой чашке Петри с питательной средой. Далее, не меняя петлю, методом остаточного материала проводят по второй и третьей чашкам Петри. Так, на последних образцах колонии бактерии будут засеваться не слишком плотно, тем самым упрощается возможность найти необходимые для работы бактерии.
2. Метод Коха. В нем используются пробирки с расплавленной питательной средой. Туда помещается петля или пипетка с мазком бактерий, после чего содержимое пробирки выливается на специальную пластинку. Агар (или желатин) застывает через какое-то время, а в его толще легко обнаружить нужные колонии клеток
Важно перед началом работы развести смесь бактерий в пробирках, чтобы концентрация микроорганизмов не была очень большой
Бактериологический метод исследования, этапы которого основаны на выделении нужной культуры бактерий, не обходится без этих двух способов нахождения изолированных колоний.
Последовательность действий и особенности методики
Для проведения бактериологического исследования необходимо выполнить сбор материала и культивировать его на питательных средах с последующей микроскопией полученных штаммов и проверкой чувствительности к антибиотикам.
Сбор материала
Биоматериалом для исследования могут служить кровь, моча, ликвор, мокрота, сперма, кал, мазки из глотки, влагалища, уретры, любые другие ткани и жидкости из области инфекционного процесса. Образцы собирают в асептических условиях, помещают в стерильную посуду и в течение 2-х часов доставляют в лабораторию. При необходимости пробы хранят при пониженных температурах.
Культивирование
Культивирование проводят с применением механических или биологических методов. Механический подход с использованием стандартных искусственных сред – наиболее распространенный. В данном случае для высевания образцов используют жидкие и твердые питательные составы. Наиболее распространенные – агар, мясо-пептонный бульон.
Посев материала производят с помощью специальной петли или пастеровской пипетки, растирая полученный образец по поверхности или вводя его в толщу питательной среды. Выделение бактерий производят из чистых культур, которые получают повторным посевом ранее выращенных колоний на новую среду.
Биологические методы подразумевают использование специальных питательных сред, которые учитывают особенности микроорганизма, в частности, чувствительность к некоторым химическим веществам, в том числе антибиотикам. В некоторых случаях применяют метод заражения лабораторных животных или тканевых культур с отслеживанием патологических изменений. Такой подход актуален при крайне незначительном накоплении микроба в тканях человека – в этом случае его выделение посевом на питательных средах не дает результата.
Микроскопическое исследование
Основной метод бактериологической диагностики – бактериоскопия. Она подразумевает визуальную оценку параметров микроорганизма под микроскопом. Для этого используют фиксированные и нефиксированные препараты.
Нефиксированные препараты позволяют исследовать живые образцы бактерий. Основные методы:
- раздавленная капля – образец придавливают между предметным и покровным стеклами;
- висячая капля – образец помещают в лунку на предметном стекле и герметично накрывают покровным.В качестве среды используют изотонический раствор или расплавленный агар. Методика позволяет наблюдать за живыми микроорганизмами в течение нескольких дней.
Фиксированные препараты используют для окрашивания с подробным изучением морфологических и некоторых биохимических параметров патогенов. Каплю бактериального состава размазывают по предметному стеклу и фиксируют пламенем горелки или специальными химическими составами.
Для определения свойств бактериальных препаратов используют ряд общих и специфических методик:
- микроскопия – определение формы, размеров, окрашивания по Граму;
- биохимические методы – исследование ферментативной способности микроорганизма к расщеплению тех или иных углеводов, аминокислот, метаболитов, в том числе способность к гемолизу, фибринолизу при попадании в кровь живых существ;
- серологические методы идентификации – реакции агглютинации под воздействием специфической сыворотки и другие антигенные свойства;
- биологические методы – заражение лабораторных ждивотных с проверкой патогенности и токсигенности взятых образцов, их устойчивости к антибиотикам.
Только совокупный анализ результатов всех методов диагностики – микроскопических, биохимических, серологических, биологических – дает объективный результат для вынесения точного диагноза.
Забор и транспортировка
Для проведения исследования требуется правильно подготовить воду. Ее забор делается по схеме:
- Берется только стерильная бутылка.
- Водопроводный кран, откуда будет делаться забор воды, предварительно обжигается.
- Из крана на протяжении 7-10 минут должна сливаться вода. Только после этого ее можно набирать в стерильную емкость.
- Тара наполовину набирается водой, закрывается пробкой и перевозится в лабораторию. При этом вода при доставке к месту анализа не должна контактировать со стерильной пробкой.
Для исследования подходит только та вода, с момента забора которой прошло не больше 1,5 часа.
Сам анализ проводится по следующему плану:
- Осуществляют подготовку лабораторной посуды и всех материалов. Вся посуда стерилизуется, промывается и тщательно сушится. Стерилизация происходит в сушильном шкафу. Температура внутри него должна быть порядка 160-165С. Посуда обрабатывается сухим жаром на протяжении часа. Вместо сушильного шкафа может применяться автоклав. В нем температура ниже – порядка 126С. Обработка длится полчаса.
- Простерилизованную посуду вынимают из шкафа только после того, когда он остынет до температурных значений меньше 60С.
- Обработанную посуду помещают в лабораторные шкафы. Они должны плотно закрываться.
- Готовят стерильную воду. Сначала исследуемая вода разливается по флаконам, которые закрываются пробками. После этого флаконы с водой стерилизуются в автоклаве в течение 20 минут при температуре 120С. Такая вода пригодна для использования в течение 2 недель.
- Готовят питательную среду. Ее компонентами может быть как мясной бульон, так и глюкоза, лактоза или фильтрованная желчь скота.
- Готовят химические реактивы для конкретного анализа.
- Подготовленную питательную среду ставят на водяную баню, после чего охлаждают до 45-50С.
- Расставляют стерильные чаши с пометками.
- Берут несколько проб питательной среды и делают два посева в стерильные чаши.
- Колбы со взятой для анализа воды открывают, обжигают их горлышки и немного продувают их воздухом через пипетку. Она должна быть стерильной.
- Чистой палочкой делается забор воды. Она добавляется в стерильные чаши, которые закрываются пробкой.
- Взятая вода заливается остуженным питательным раствором. Чаша со смесью быстро перемешивается вращательными движениями. Далее чаша ставится на ровную поверхность. Смесь внутри нее должна застыть.
- Чаша с застывшим раствором переворачивается вверх дном и ставится в термостат. Там создается оптимальная среда для выращивания посевов (37С). Чаша находится в термостате сутки.
- Чаша с выращенными колониями микроорганизмов кладется на затемненный фон вверх дном. При помощи лупы делается подсчет количества появившихся колоний бактерий. При подсчетах учитывается число микроорганизмов на 1 см3 взятой для анализа воды.
- Результаты фиксируются в протоколе и регистрационном журнале. Дополнительно фиксируются особые условия, при которых проходил анализ.
2.1. Понятие о санитарно-показательных микроорганизмах
Микроорганизмы, обитающие в кишечнике или в верхнем отделе дыхательных путей человека и животных и постоянно выделяющиеся окружающую среду, называются санитарно — показательными.
По количеству СПМ можно косвенно судить о возможном присутствии патогенов во внешней среде. То есть при их определении исходят из предположения, что чем больше объект загрязнен выделениями человека и животных, тем больше будет СПМ и тем вероятнее присутствие патогенов.
Основные требования, предъявляемые к санитарно-показательным микроорганизмам, следующие:
1) постоянное обитание в естественных полостях организма человека и животных (которые являются их единственной природной средой обитания — биотопом) и выделение их в большом количестве в окружающую среду;
2) продолжительность выживания их в окружающей среде должна быть такой же или большей, чем патогенных микроорганизмов, выводимых из организма теми же путями;
3) не должны размножаться в окружающей среде;
4) не должны сколько-нибудь значительно изменять свои биологические свойства при попадании в окружающую среду;
6) индикация, идентификация и количественный учет должны производиться современными, простыми, легко доступными и экономичными микробиологическими методами.
Все санитарно-показательные микроорганизмы являются индикаторами биологического загрязнения. Выделяют несколько групп микроорганизмов, обнаружение которых в объектах окружающей среды говорит о различных видах загрязнения. Но между группами СПМ нет четких границ, так как некоторые микроорганизмы являются показателями различных видов загрязнения.
Группа А включает обитателей кишечника человека и животных. Они являются индикаторами фекального загрязнения. В нее входят бактерии группы кишечной палочки (БГКП) – эшерихии, цитробактер, энтеробактер, клебсиеллы. Кроме того, в эту группу входят энтерококки, протеи, сальмонеллы, клостридии, термофилы, бактероиды, бактериофаги и др.
Группа В включает обитателей верхних дыхательных путей и носоглотки. Они являются индикаторами орального загрязнения. В нее входят стафилококки (S. aureus), а также зеленящие и гемолитические стрептококки, постоянно обитающие на слизистой оболочке верхних дыхательных путей и выделяющиеся в воздушную среду при разговоре, кашле, чиханье.
Микробиологический контроль объектов I группы
1.1 Правила проведения микробиологического контроля продуктов
При производстве объектов фармакологической группы должен выполняться микробиологический контроль не только готовой продукции, но и объектов окружающей среды. При этом должны быть соблюдены следующие правила:
- процесс микробиологического контроля продуктов должен быть осуществлен в соответствии с Приказом Минздрава РФ от 24.04.2003 N172;
- нестерильные лекарственные препараты подвержены возможности их контаминирования и могут содержать определенное число микроорганизмов, не несущих вреда здоровью человека;
- при проведении испытаний на стерильность должны быть соблюдены условия, исключающие инфекционное заражение.
1. Испытание на стерильность
Некоторые категории лекарственных средств (глазные капли, растворы для инъекций и др.) должны быть полностью стерильными. Однако, метод контроля стерильности используют для проверки всех фармакологических препаратов. Происходит это следующим образом:
- а) Выявление антимикробных свойств препарата. Процесс заключается в помещении тестируемых микроорганизмов на питательную среду, и при обнаружении антимикробных свойств в объект исследования вносят специальные инактиваторы, перечень которых указан в соответствующих нормативных документах.
- б) Испытание на стерильность.
Исследуемые микроорганизмы продуктов помещают в различные виды жидкой среды, чтобы определить наличие аэробных и анаэробных бактерий, а также грибов.
2. Метод мембранной фильтрации
Данный метод микробиологического контроля продуктов заключается в исследовании организмов с применением специальной фильтрационной установки.
- а) Подготовка проб. Пробное количество клеток помещают на фильтр и воздействуют на них давлением или вакуумом.
- б) Валидация.
После осуществления фильтрации производят выявление роста микроорганизмов в исследуемой массе. В случае, если произошло размножение клеток, делают вывод о том, что изучаемый объект не обладает антимикробными свойствами.
Бактериоскопический метод исследования
Клетки микроорганизмов
можно изучать как в живом состоянии
(метод раздавленной капли и метод висячей
капли), так и в фиксированном и окрашенном
состоянии.
Метод раздавленной
капли. На
поверхность обезжиренного предметного
стекла наносят каплю исследуемого
материала или суспензию бактерий и
покрывают ее покровным стеклом. Капля
не должна выходить за края покровного
стекла. Микроскопируют препарат с
объективом х40. Метод раздавленной капли
удобен для исследования подвижности
бактериальных клеток, а также для
изучения крупных микроорганизмов —
плесневых грибов, дрожжей.
Метод висячей
капли.
Препарат готовят на покровном стекле,
в центр которого наносят каплю
бактериальной суспензии. Затем специальное
предметное стекло с лункой, края которой
предварительно смазаны вазелином,
прижимают к покровному стеклу так, чтобы
капля находилась в центре лунки. Препарат
переворачивают покровным стеклом вверх.
В правильно приготовленном препарате
капля должна свободно висеть над лункой,
не касаясь ее дна или краев. Для микроскопии
используют вначале сухой объектив х8,
под увеличением которого находят края
капли, а затем устанавливают объектив
х40 и исследуют препарат.
Приготовление
фиксированных препаратов.
Для приготовления препарата на
обезжиренное предметное стекло наносят
каплю воды или изотонического раствора
хлорида натрия, в которую бактериологической
петлей вносят исследуемый материал и
круговыми движениями петли распределяют
его таким образом, чтобы получить тонкий
и равномерный мазок диаметром 1-1,5 см.
Если исследуют жидкий материал, то его
наносят на предметное стекло непосредственно
петлей и готовят мазок. Мазки высушивают
на воздухе.
Для фиксации
используют физические и химические
методы. Для фиксации мазка физическим
методом предметное стекло медленно
проводят 3 раза через пламя горелки.
Мазки крови, мазки-отпечатки органов и
тканей фиксируют химическим методом
путем погружения их на 5-20 минут в
метиловый или этиловый спирт, смесь
Никифорова и другие фиксирующие жидкости.
Для окрашивания
микробов используют простые и сложные
методы. При простом методе фиксированный
мазок окрашивают каким-либо одним
красителем, например, водным раствором
фуксина (1-2 минуты) или метиленовым синим
(3-5 минут), промывают водой, высушивают
и микроскопируют. Сложные методы
окрашивания включают последовательное
использование нескольких красителей.
Это позволяет выявить определенные
структуры клеток и дифференцировать
одни виды микроорганизмов от других.
Методы и цели микробиологии
К методам исследования любых микроорганизмов относят:
- микроскопия: световая (в том числе фазово-контрастная, темнопольная, флуоресцентная) и электронная;
- культуральный метод (бактериологический, вирусологический);
- биологический метод (заражение лабораторных животных с воспроизведением инфекционного процесса на чувствительных моделях);
- молекулярно-генетический метод (ПЦР, ДНК- и РНК-зонды и др.);
- серологический метод — выявления антигенов микроорганизмов или антител к ним (ИФА).
Цель медицинской микробиологии — изучение структуры и свойств патогенных микробов, взаимоотношения их с организмом человека в определенных условиях природной и социальной среды, совершенствование методов микробиологической диагностики, разработка новых, более эффективных лечебных и профилактических препаратов, решение такой важной проблемы, как ликвидация и предупреждение инфекционных болезней
Приказ 535 «Об унификации микробиологических методов исследования»
Бактериологический анализ занимает важнейшее место в комплексе клинико-лабораторных мероприятий, направленных на диагностику, профилактику и лечение разнообразных инфекционных заболеваний. Однако исследованием окружающей среды они не ограничиваются.
Особое значение имеет бактериологический анализ биологического материала в лечебных учреждениях. К исследованиям, проводимым в медучреждениях, предъявляются повышенные требования. Целью Приказа «Об унификации микробиологических методов исследования» является совершенствование бактериологического анализа, повышение качества и эффективности микробиологической диагностики.
Методы микробиологической диагностики
Введение
На первый взгляд работа с Access
кажется не столь простой, как, например, работа с текстовым редактором, где
можно сразу же приступать к набору теста. Прежде чем мы вообще сможем управлять
собственными данными с помощью Access, необходимо
создать базу данных состоящую из таблиц. В данной работе будет описано, как это
сделать. Представленные в данной работе решения задач призваны дать по
возможности хорошее понимание темы и развить навыки для достижения цели
кратчайшим путем.
На основе базовых таблиц создаем запросы,
которые обеспечивают быстрый и эффективный доступ к данным, хранящимся в
таблице
Поэтому они представляют собой важное дополнение к таблицам. В Access результат запроса можно всегда использовать так же,
как таблицу
На основании запроса можно разработать форму или отчет.
Далее создаем формы, которые являются наиболее
удобным средством отображения данных. Преимущество формы для ввода и
редактирования данных состоит в простоте и наглядности, так как записи таблицы
или запроса представлены в форме в удобном виде.
Создаем отчеты позволяющие представить и
распечатать данные в соответствии с требованиями пользователя. Причем
возможности оформления данных для вывода на печать настолько же гибки, как и
возможности отображения на экране.
И на основе проделанной работы создаем главную
кнопочную форму (меню) для навигации по БД «Антипова».
Задание № 1.
Разработать структуру базовых таблиц (не менее
двух) базы данных (смотри таблицу заданий к работе), удовлетворяющих
требованиям целостности, непротиворечивости и не избыточности. Такая структура
базовых таблиц называется схемой данных. В таблицах в соответствии с типом
данных, размещенных в каждом поле, определите наиболее подходящий тип для
каждого поля.
Базы данных – это совокупность структур,
предназначенных для хранения больших объёмов информации и программных модулей,
осуществляющих управление данными, их выборку, сортировку и другие подобные
действия. Информация базы данных хранится в одной или нескольких таблицах.
Любая таблица с данными состоит из набора однотипных записей, расположенных
друг за другом. Они представляют собой строки таблицы, которые можно добавлять,
удалять или изменять. Каждая запись представляет собой набор именованных полей,
или ячеек, которые могут хранить самую разнообразную информацию, начиная от
даты рождения и заканчивая подробным описанием кулинарного рецепта. Однотипные
поля образуют столбец таблицы.
Записи одной таблицы
могут содержать ссылки на данные другой таблицы. Взаимодействие таблиц
называется связью.
Другие модули базы данных
предназначены для обработки информации, хранящейся в таблицах. С помощью
запросов производится выборка данных, отвечающих определённым условиям. Формы
предназначены для форматированного ввода и восприятия информации. Отчёты
обеспечивают вывод (как правило, на принтер) красочно оформленного списка
записей с заголовками, пунктами и подпунктами.
Конструктор таблиц предназначен
для задания и изменения структуры таблицы.
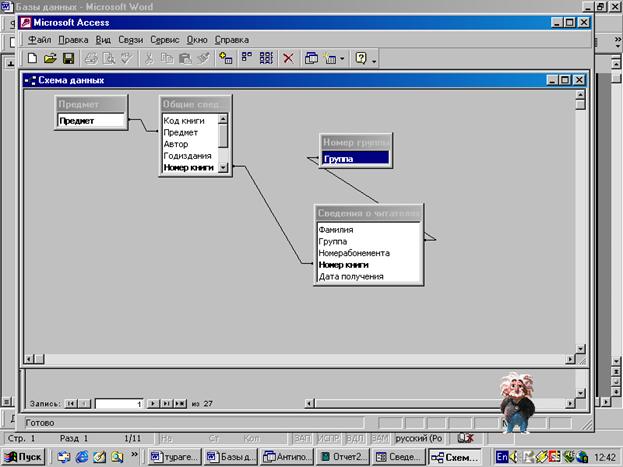
Разработаем две таблицы для
библиотеки.
Сведения о книгах
Сведения о читателях

Задание № 2.
Создать структуры
базовых таблиц, и наполнить их содержимым состоящим более чем из 15 записей.
При создании структуры таблиц целесообразно задавать ключевые (уникальные)
поля. Это поможет в дальнейшем для организации связей между таблицами.
Для заполнения этих таблиц
использовали в качестве Подстановки вспомогательные таблицы Номер группы и
Предмет. Также использовали ввод текущей даты по умолчанию с помощью Функции data ()
|
Предмет |
|
Предмет |
|
КСЕ |
|
Математика |
|
Немецкий язык |
|
Физика |
|
Экономика |
|
Номер группы |
|
Группа |
|
Э-113 |
|
Э-114 |
|
Э-115 |
Заполняем таблицы
данными.