Теория и схема кроветворения. морфология клеток костного мозга
Содержание:
- В Т- и в В-лимфоцитопоэзе выделяют три этапа:
- Эмбриональное кроветворение.
- Контроль гемоцитопоэза
- Регуляция кроветворения
- Кроветворение в антенатальном периоде
- Назначение схемы гемопоэза
- Регуляция кроветворения
- Регуляция гемопоэза
- Свойства колониеобразующих тканей
- Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
- Особенности процесса образования клеток крови: теории и факты
- Роль витамина В12 в кроветворении
- Где это происходит?
- Основные этапы производства крови в организме
- I. Кровь — внутренняя среда организма. Состав и функции крови.
В Т- и в В-лимфоцитопоэзе выделяют три этапа:
- костномозговой этап;
- этап антиген—независимой дифференцировки, осуществляемый в центральных иммунных органах;
- этап антиген—зависимой дифференцировки, осуществляемый в периферических лимфоидных органах.
Первый этап Т-лимфоцитопоэза осуществляется в лимфоидной ткани красного костного мозга, где образуются следующие классы клеток:
- 1 класс — стволовые клетки;
- 2 класс — полустволовые клетки-предшественницы лимфоцитопоэза;
- 3 класс — унипотентные Т-поэтинчувствительные клетки—предшественницы Т-лимфоцитопоэза, эти клетки мигрируют в кровеносное русло и с кровью достигают тимуса.
Второй этап — этап антигеннезависимой дифференцировки осуществляется в корковом веществе тимуса. Здесь продолжается дальнейший процесс Т-лимфоцитопоэза. Под влиянием биологически активного вещества тимозина, выделяемого стромальными клетками, унипотентные клетки превращаются в Т-лимфобласты — 4 класс, затем в Т-пролимфоциты — 5 класс, а последние в Т-лимфоциты — 6 класс.
Третий этап — этап антигенезависимой дифференцировки осуществляется в Т-зонах периферических лимфоидных органов — лимфоузлов, селезенки и других, где создаются условия для встречи антигена с Т-лимфоцитом (киллером, хелпером или супрессором), имеющим рецептор к данному антигену.
Первый этап В-лимфоцитопоэза осуществляется в красном костном мозге, где образуются следующие классы клеток:
- 1 класс — стволовые клетки;
- 2 класс — полустволовые клетки-предшественницы лимфопоэза;
- 3 класс — унипотентные В-поэтинчувствительные клетки-предшественницы В-лимфоцитопоэза.
Второй этап антигеннезависимой дифференцировки у птиц осуществляется в специальном центральном лимфоидном органе — фабрициевой сумке.
Третий этап — антигензависимая дифференцировка осуществляется в В-зонах периферических лимфоидных органов (лимфатических узлов, селезенки и других) где происходит встреча антигена с соответствующим В-рецепторным лимфоцитом, его последующая активация и трансформация в иммунобласт.
Эмбриональное кроветворение.
Кроветворение во внутриутробном периоде
развития начинается рано. По мере роста
эмбриона и плода последовательно
меняется локализация гемопоэза в
различных органах.
Табл. 1. Развитие гемопоэтической системы
человека
(по Н.С. Кисляк, Р.В. Ленской, 1978).
|
Локализация кроветворения |
Период эмбриогенеза (недели) |
|
Желточный мешок |
3 – 4 |
|
Начало кроветворения в печени |
5 – 6 |
|
Появление больших лимфоцитов в тимусе |
9 – 10 |
|
Начало гемопоэза в селезенке |
Конец 12-й |
|
Появление гемопоэтических очагов в |
13 – 14 |
|
Лимфопоэз в лимфоузлах |
16 – 17 |
|
Появление циркулирующих малых |
17 |
|
Начало лимфопоэза в селезенке |
20 |
Начинается кроветворение в желточном
мешке на 3-й неделе развития человеческого
эмбриона. В начале оно сводится в основном
к эритропоэзу. Образование первичных
эритробластов (мегалобласты) происходит
внутри сосудов желточного мешка.
На 4-й неделе кроветворение появляется
в органах эмбриона. Из желточного мешка
гемопоэз перемещается в печень, которая
к 5-й недели гестации становится центром
кроветворения. С этого времени наряду
с эритроидными клетками начинают
образовываться первые гранулоциты и
мегакариоциты, при этом мегалобластический
тип кроветворения сменяется на
нормобластический. К 18-20-й неделе развития
человеческого плода кроветворная
активность в печени резко снижена, а к
концу внутриутробной жизни, как правило,
совсем прекращается.
В селезенке кроветворение начинается
с 12-й недели, образуются эритроциты,
гранулоциты, мегакариоциты. С 20-й недели
миелопоэз в селезенке сменяется
интенсивным лимфопоэзом.
Первые лимфоидные элементы появляются
на 9-10 неделе в строме тимуса, в процессе
их дифференцировки образуются
иммунокомпетентные клетки – Т-лимфоциты.
К 20-й неделе тимус по соотношению малых
и средних лимфоцитов сходен с тимусом
доношенного ребенка, к этому времени в
сыворотке крови плода начинают
обнаруживаться иммуноглобулины М и G.
Костный мозг закладывается в конце 3-го
месяца эмбрионального развития за счет
мезенхимальных периваскулярных
элементов, проникающих вместе с
кровеносными сосудами из периоста в
костномозговую полость. Гемопоэтические
очаги в костном мозге появляются с 13-14
недели внутриутробного развития в
диафизах бедренных и плечевых костей.
К 15-й неделе в этих локусах отмечается
обилие юных форм грануло-, эритро- и
мегакариоцитов. Костномозговое
кроветворение становится основным к
концу внутриутробного развития и на
протяжении всего постнатального периода.
Костный мозг в пренатальном периоде
красный. Его объем с возрастом плода
увеличивается в 2,5 раза и к рождению
составляет порядка 40 мл. и он присутствует
во всех костях. К концу гестации начинают
появляться в костном мозге конечностей
жировые клетки. После рождения в процессе
роста ребенка масса костного мозга
увеличивается и к 20 годам составляет в
среднем 3000 г, но на долю красного костного
мозга будет приходиться порядка 1200 г,
и он будет локализоваться в основном в
плоских костях и телах позвонков,
остальная часть будет замещена желтым
костным мозгом.
Основным отличие состава форменных
элементов крови плода является постоянное
нарастание числа эритроцитов, содержания
гемоглобина, количества лейкоцитов.
Если в первой половине внутриутробного
развития (до 6 месяцев) в крови обнаруживаются
много незрелых элементов (эритробластов,
миелобластов, промиелоцитов и миелоцитов),
то в последующие месяцы в периферической
крови плода содержатся преимущественно
зрелые элементы.
Изменяется и состав гемоглобина. Вначале
(9-12 нед) в мегалобластах находится
примитивный гемоглобин (HbP),
который заменятся фетальным (HbF).
Он становится основной формой в
пренатальном периоде. Хотя с 10-й недели
начинают появляться эритроциты с
гемоглобином взрослого типа (HbA),
доля его до 30 недели составляет лишь
10%. К рождению ребенка фетальный гемоглобин
составляет приблизительно 60%, а взрослый
– 40% всего гемоглобина эритроцитов
периферической крови
Важным физиологическим
свойством примитивного и фетального
гемоглобинов является их более высокое
сродство к кислороду, что имеет важное
значение во внутриутробном периоде для
обеспечения организма плода кислородом,
когда оксигенация крови плода в плаценте
относительно ограничена по сравнению
с оксигенацией крови после рождения в
связи с установлением легочного дыхания
Контроль гемоцитопоэза
Гемоцитопоэз объединяет процессы, связанные с преобразованием различных клеток в зрелые элементы крови. Так обеспечивается естественное сокращение лишнего количества форменных элементов. Полипотентные стволовые клетки самостоятельно проходят регенерацию. Они могут образовываться вне органов кроветворения. При стандартной дифференциации полипотентные клетки, сосредоточенные в костном мозге, способствуют зарождению зрелых элементов крови. Это:
- базофилы;
- эритроциты;
- различные типы лимфоцитов;
- эозинофилы;
- нейтрофилы.
К ним относят:
- попадание инфекции в организм;
- механические повреждения и другие факторы, способствующие потере определенного количества крови;
- адаптация к условиям высокогорья.
Регуляция кроветворения
Регуляция кроветворения осуществляется посредством взаимодействия генетического потенциала с факторами окружающей среды, которые включают микросреду и факторы роста. Факторы роста, также называемые гемопоэтическими цитокинами, представляют собой семейство из более чем 20 гликопротеинов. Они продуцируются стромальными клетками, эндотелиальными клетками, фибробластами, макрофагами, лимфоцитами и другими. Некоторыми из наиболее известных гематопоэтических цитокинов являются гранулоцит-колониестимулирующий фактор, моноцит-колониестимулирующий фактор, эритропоэтин, тримбоцитопоэтин и другие. Их эффекты выражаются в стимулирующем или ингибирующем влиянии на деление, дифференцировку, пролиферацию и апоптоз клеток. Кроме того, они облегчают взаимодействие между стволовыми клетками и компонентами микроокружения.
Эритропоэтин – это гормон, который регулирует образование красных кровяных клеток. Вырабатывается в почках и в печени. Эритропоэтин действует путем связывания с рецепторами, расположенными на мембране эритроидных клеток. Эта связь между гормоном и рецептором стимулирует их дифференциацию и пролиферацию. Эритропоэтин действует на поздних стадиях эритропоэза.
Тромбоцитопоэтин – это гормон, который вырабатывается в печени на ранних стадиях кроветворения. В нормальных условиях большинство клеток костного мозга не делятся. Более зрелые клетки-предшественники пролиферируют и образуют относительно постоянное количество клеток крови, а некоторые из них подвергаются апоптозу. Этот тип кроветворения называют конститутивным, потому что это происходит в относительно постоянных условиях. Также различают индуцибельный гемопоэз, который стимулируется при наличии стресса в организме.
Кроветворение является жизненно важным процессом, подлежащим точной регуляции. Благодаря этому количество клеток крови в организме поддерживается относительно постоянным. Это позволяет крови выполнять свои важные физиологические функции.
Кроветворение в антенатальном периоде
Кроветворение в антенатальном периоде впервые обнаруживается у 19-дневного эмбриона в кровяных островках желточного мешка, в стебле и хорионе. К 22-му дню первые кровяные клетки проникают в мезодермальную ткань эмбриона, в сердце, аорту, артерии. На 6-й нед. снижается активность К. в желточном мешке. Полностью первый (мезобластический) период гемопоэза, преимущественно эритроцитопоэза, заканчивается к началу 4-го мес. жизни эмбриона. Примитивные кроветворные клетки желточного мешка накапливают гемоглобин и превращаются в примитивные эритробласты, названные П. Эрлихом мегалобластами.
Второй (печеночный) период К. начинается после б нед. и достигает максимума к 5-му мес. К. этого периода преимущественно эритроидное, хотя на 9-й нед. в печени уже созревают первые нейтрофилы. Печеночный период эритроцитопоэза характеризуется исчезновением мегалобластов; при этом эритрокариоциты имеют нормальные размеры. На 3-м мес. эмбриональной жизни в эритроцитопоэз включается селезенка, но у человека ее роль в пренатальном К. ограничена.
На 4-5-м мес. начинается третий (костномозговой) период К. Миелоидный эритроцитопоэз плода — эритробластический и, как и лейкоцитопоэз, мало отличается от эритроцитопоэза взрослого.
Общей закономерностью эмбрионального эритроцитопоэза является постепенное уменьшение размеров эритроцитов и увеличение их числа. Соответственно различным периодам К. (мезобластическому, печеночному и костномозговому) существует три разных типа гемоглобина: эмбриональный, фетальный и гемоглобин взрослого. В основном переход от фетального гемоглобина к гемоглобину взрослого начинается на 3-й нед. жизни плода и заканчивается через 6 мес. после рождения.
В первые дни у новорожденных наблюдается полиглобулия и нейтрофильный лейкоцитоз. Затем активность эритроцитопоэза снижается. Нормализуется он в возрасте 2-3 мес. Нейтрофилез первых дней жизни сменяется лимфоцитозом; только к 5 годам в лейкоцитарной формуле начинают преобладать нейтрофилы.
Назначение схемы гемопоэза
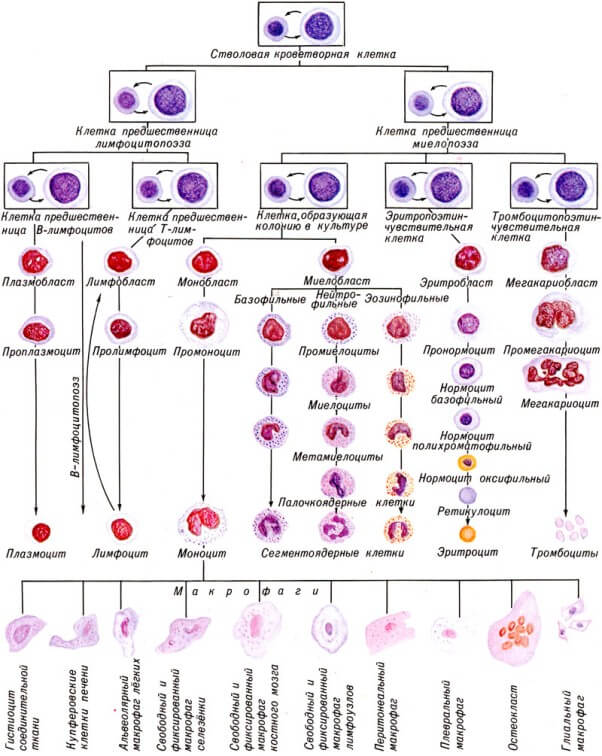
Схема гемопоэза
Все выше сказанное можно объединить в единую схему.
Назначение такой схемы трудно переоценить. Она имеет огромное количество плюсов и несомненную значимость.
- При помощи такой схемы можно отчетливо отследить все этапы образования интересующей клетки.
- Если нужная клетка не образовалась, можно отследить на каком этапе произошла ошибка и цепочка действий прервалась.
- Найдя ошибку в системе, врач может воздействовать на интересующее звено кроветворения, чтобы его простимулировать.
Таким образом, схема гемопоэза ясно представляет структуру периферической крови по компонентам, что также немаловажно в диагностике патологических процессов
Регуляция кроветворения
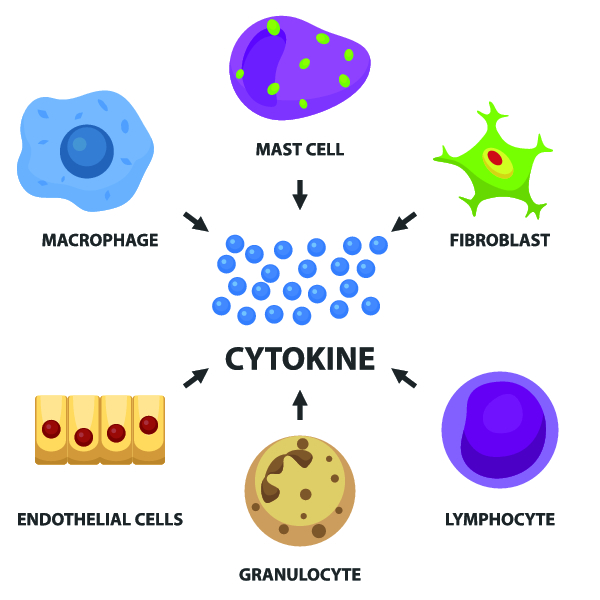 Адекватный и быстрый ответ системы кроветворения на вновь возникающие потребности организма в клетках крови обеспечивают цитокины.
Адекватный и быстрый ответ системы кроветворения на вновь возникающие потребности организма в клетках крови обеспечивают цитокины.
В норме регуляция гемопоэза осуществляется непосредственным влиянием микроокружения и гуморальными факторами, обладающими активирующим или угнетающим действием. Эти факторы получили название цитокины. Они позволяют обеспечивать адекватный и быстрый ответ системы кроветворения на вновь возникающие потребности организма в клетках крови. К цитокинам активирующего типа относятся:
- факторы роста (колониестимулирующие);
- эритропоэтины;
- фактор стволовых клеток;
- интерлейкины и др.
Угнетают клеточную активность и кроветворение следующие субстанции:
- фактор некроза опухоли;
- интерферон-гамма;
- лейкоз-ингибирующий фактор и др.
При этом подавление роста одного вида клеток может приводить к усиленной дифференцировке другого.
Количество клеток в периферической крови регулируется по принципу обратной связи. Так, содержание эритроцитов в крови и насыщение их гемоглобином зависит от потребностей тканей в кислороде. Если она возрастает, то включаются не только компенсаторные механизмы (увеличение частоты дыхания и сердечных сокращений), но и стимулируется эритропоэз.
Регуляция гемопоэза
Кроветворение регулируется:
- факторами роста, обеспечивающими пролиферацию и дифференцировку СКК и последующих стадий их развития,
- факторами транскрипции, влияющими на экспрессию генов, определяющих направление дифференцировки гемопоэтических клеток,
- витаминами, гормонами.
Факторы роста включают колониестимулирующие факторы (КСФ), интерлейкины и ингибирующие факторы. Они являются гликопротеинами, действующими и как циркулирующие гормоны, и как местные медиаторы, регулирующие гемопоэз и дифференцировку специфических типов клеток. Почти все факторы роста действуют на СКК, КОЕ, коммитированные и зрелые клетки. Однако отмечаются индивидуальные особенности действия этих факторов на клетки-мишени.
КСФ действуют на специфические клетки или группы клеток на различных стадиях дифференцировки. Например, фактор роста стволовых клеток влияет на пролиферацию и миграцию СКК в эмбриогенезе. В постнатальном периоде на гемопоэз оказывают влияние несколько КСФ, среди которых наиболее изучены факторы, стимулирующие развитие гранулоцитов и макрофагов (ГМ-КСФ, Г-КСФ, М-КСФ), а также интерлейкины.
Большинство указанных факторов выделено и применяется для лечения различных болезней. Для получения их используются биотехнологические методы.
Дифференцировка полипотентных клеток в унипотентные определяется действием ряда специфических факторов, поэтинов — эритропоэтинов (для эритробластов), гранулопоэтинов (для миелобластов), лимфопоэтинов (для лимфобластов), тромбопоэтинов (для мегакариобластов).
Большая часть эритропоэтина образуется в почках. Его образование регулируется содержанием в крови кислорода, которое зависит от количества циркулирующих в крови эритроцитов. Снижение числа эритроцитов и соответственно парциального давления кислорода, является сигналом для увеличения продукции эритропоэтина. Эритропоэтин действует на чувствительные к нему КОЕ-Э, стимулируя их пролиферацию и дифференцировку, что в конечном итоге приводит к повышению содержания в крови эритроцитов.
Тромбопоэтин синтезируется в печени, стимулирует пролиферацию КОЕ-МГЦ, их дифференцировку и образование тромбоцитов.
Ингибирующие факторы дают противоположный эффект, т.е. тормозят гемопоэз; их недостаток может быть одной из причин лейкемии, характеризующейся значительным увеличением числа лейкоцитов в крови. Выделен ингибирующий лейкемию фактор (ЛИФ), который тормозит пролиферацию и дифференцировку моноцитов-макрофагов.
Витамины необходимы для стимуляции пролиферации и дифференцировки гемопоэтических клеток. Витамин В12 поступает с пищей и соединяется с внутренним фактором (Касла), который синтезируется париетальными клетками желудка. Образуемый при этом комплекс, в присутствии ионов Са2+, соединяется с рецепторами эпителиоцитов подвздошной кишки и всасывается. При всасывании в эпителиоциты поступает лишь витамин В12, а внутренний фактор освобождается. Витамин В12 поступает с кровью в костный мозг, где влияет на гемопоэз, и в печень, где может депонироваться. Нарушение процесса всасывания при различных заболеваниях желудочно-кишечного тракта может служить причиной дефицита витамина В12 и нарушений в гемопоэзе.
Некоторые термины из практической медицины:
- анемия (син. малокровие) — состояние, характеризующееся снижением содержания гемоглобина в единице объема крови, чаще при одновременном уменьшении количества эритроцитов;
- анемия ахрестическая — общее название анемий, развивающихся вследствие неспособности эритробластов костного мозга использовать какие-либо антианемические факторы (цианокобаламин, фолиевую кислоту, железо и др.) при их нормальном поступлении в организм;
- хлороз ранний (син.: бледная немочь, хлороз ювенильный) — железодефицитная анемия у девушек в период полового созревания, проявляющаяся алебастровой бледностью кожи с зеленоватым оттенком, извращением вкуса, олигоменореей;
- хлороз поздний (син. анемия железодефицитная эссенциальная) — железодефицитная анемия у женщин в возрасте старше 30 лет, обычно связанная с маточными или другими кровотечениями, проявляющаяся извращением вкуса и обоняния, признаками атрофии слизистой оболочки полости рта и пищевода, выпадением волос, искривлением ногтей, позже — выраженными признаками анемии;
Свойства колониеобразующих тканей
Из соединений могут формироваться предшественники эритроцитов, которые носят название ретикулоцитов, а также эозинофилов, моноцитов и и базофилов. Образование клеток плазмы и Т-лимфоцитов происходит с участием селезенки, тимуса и ткани лимфы. Процессы захвата могут иметь место в селезенке.
Говоря про колониеобразующие ткани, надо указать гемоцитопоэзиндуцирующее микроокружение (ГИМ). В процессе его образования принимают участие элементы, входящие в состав паренхимы костного мозга и стромы. Они отвечают за образование макрофагов, эндотелиоцитов капилляров и более крупных сосудов. Эти компоненты выступают основой для закладки нервно-мышечных тканей. ГИМ передают в клетки специальные сигналы, направленные на регуляцию той или иной функции.
Микроокружение участвует в обеспечении полноценного метаболизма. Гемоцитопоэз состоит из множества сложных этапов. Он отвечает за поддержание постоянства, торможения или ускорения деятельности клеток. Регуляция интенсивности гемопоэза должна происходить сообразно меняющимся потребностям органов и систем. При этом может происходить как торможение, так и ускорение, в зависимости от обстоятельств. Обязательно является поступление информации в виде сигналов. Это обеспечивается нейромедиаторами и гормонами.
Кроветворение будет полноценным, если синтезируется достаточно пластических и энергетических веществ, минералов, витаминов. Регуляция базируется на образовании взрослых клеток из стволовых, расположенных в тканях костного мозга, и гормонов с нейромедиаторами. В нем принимают участие цитокины. Факторы микроокружения способны стимулировать гемопоэз, другие направлены на процесс торможения. Транскрипционные отвечают за внутреннюю регуляцию дифференцировки в клеточных ядрах.
Воздействие на кроветворные стволовые клетки обеспечивается влиянием на них нескольких факторов одновременно. Специфические рецепторы, которые включены в состав клеток крови, испытывают на себе стимулирующее действие указанных веществ и факторов.
Предыдущая
АнатомияЭритроциты в крови где образуются, строение, функции и продолжительность жизни, что значит повышенные эритроциты, какая норма, где в организме человека происходит разрушение эритроцитов
Следующая
АнатомияСтроение уха человека схема с описанием, что расположено в средней части уха, анатомия внутреннего и наружного уха, ушной раковины, барабанная полость
Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
Васкуляризация. Костный мозг снабжается кровью посредством сосудов, проникающих через надкостницу в специальные отверстия в компактном веществе кости. Войдя в костный мозг, артерии разветвляются на восходящую и нисходящую ветви, от которых радиально отходят артериолы. Сначала они переходят в узкие капилляры (2—4 мкм), а затем в области эндоста продолжаются в широкие тонкостенные с щелевидными порами синусы (диаметром 10—14 мкм). Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиальном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере контакта с костной тканью кровь обогащается минеральными солями и регуляторами кроветворения.
Кровеносные сосуды составляют половину (50%) массы костного мозга, из них 30% приходится на синусы. В костном мозге разных костей человека артерии имеют толстую среднюю и адвентициальную оболочки, многочисленные тонкостенные вены, причем артерии и вены редко идут вместе, чаще врозь.
Капилляры бывают двух типов: узкие 6—20 мкм и широкие синусоидные (или синусы) диаметром 200—500 мкм. Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране.
Иннервация. В иннервации участвуют нервы сосудистых сплетений, нервы мышц и специальные нервные проводники к костному мозгу. Нервы проникают в костный мозг вместе с кровеносными сосудами через костные каналы. Далее покидают их и продолжаются как самостоятельные веточки в паренхиме в пределах ячеек губчатого вещества кости. Они ветвятся на тонкие волоконца, которые либо вновь вступают в контакт с костномозговыми сосудами и оканчиваются на их стенках, либо заканчиваются свободно среди клеток костного мозга.
Возрастные изменения. Красный костный мозг в детском возрасте заполняет эпифизы и диафизы трубчатых костей и находится в губчатом веществе плоских костей. Примерно в 12—18 лет красный костный мозг в диафизах замещается желтым. В старческом возрасте костный мозг (желтый и красный) приобретает слизистую консистенцию и тогда называется желатинозным костным мозгом. Следует отметить, что этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Регенерация. Красный костный мозг обладает высокой физиологической и репаративной регенерационной способностью. Источником образования гемопоэтических клеток являются стволовые клетки, находящиеся в тесном взаимодействии с ретикулярной стромальной тканью. Скорость регенерации костного мозга в значительной мере связана с микроокружением и специальными ростстимулирующими факторами гемопоэза.
Некоторые термины из практической медицины:
- миелограмма (миело- + греч. gramma запись) — выраженный в форме таблицы или диаграммы результат микроскопии мазка пунктата костного мозга, отражающий качественный и количественный состав ядросодержащих клеток миелоидной ткани.;
- миелоидная реакция (миело- + греч. —eides подобный) — появление в периферической крови малодифференцированных клеток, относящихся к грануло- и эритропоэтическому ряду; наблюдается при метастазах злокачественной опухоли в костный мозг, а также при сепсисе, туберкулезе и некоторых других болезнях;
- остеомиелит (osteomyelitis; остео- + греч. myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
| Часть первая – Общая характеристика, классификация; красный костный мозг | immunesys1.mp37 122 кБ |
| Часть вторая – Вилочковая железа — тимус | immunesys2.mp35 310 кБ |
| Часть третья – Селезенка | immunesys3.mp36 073 кБ |
| Часть четвертая – Лимфатические узлы, лимфоидная ткань слизистых оболочек | immunesys4.mp37 152 кБ |
Особенности процесса образования клеток крови: теории и факты
Процесс образования клеток крови идет непрерывно в течение всей человеческой жизни, интенсивность его строго соответствует потребностям организма.
По одной из современных теорий следует, что клетки крови человека — эритроциты, лейкоциты и тромбоциты происходят из единой родоначальной материнской клетки, так называемой «стволовой». Путем ее деления и развития появляются клепки, предопределяющие различные ветви кроветворения: образование эритроцитов, зернистых лейкоцитов (гранулоцитов), незернистых лейкоцитов (агранулоцитов), тромбоцитов.
Порожденная общей «стволовой» клеткой, каждая из этих ветвей имеет и свою собственную родоначальную клетку. В процессе деления и постепенного созревания и преобразования этих костномозговых элементов появляются зрелые клетки, поступающие в кровь.
К чести русской науки следует оказать, что мысль о происхождении всех клеток крови из единого источника принадлежит знаменитому русскому ученому-гистологу А. А. Максимову, создавшему еще в 1900—1914 гг. свою теорию кроветворения. Эти исследования нашли подтверждение и дальнейшее развитие в трудах советских исследователей.
Вместе с тем в некоторыми учеными высказывалась мысль о том, что еще до рождения человека в кроветворных органах предопределен вид каждой кроветворной линии — гранулоцитарной, эритроцитарной, лимфоцитарной. В пользу такой точки зрения приводятся данные биохимических исследований клеток крови и костного мозга.
Так, советские биохимики П. Ф. Сейц и П. С. Луганова обнаружили, что для определенных линий кроветворных элементов характерен определенный вид энергетического обмена. На основании этих данных они полагали, что и происхождение клеточных форм на каком-то этапе должно быть различным, поскольку характерный тип обмена (как группа крови, резус-фактор), возникший в клетке в начальном периоде ее развития, сохраняется во всех клеточных популяциях (производных данной линии).
Роль витамина В12 в кроветворении
В кроветворении принимают участие различные витамины, среди которых особая роль принадлежит витамину В12, содержащему кобальт.
Источником витамина В12 служат продукты животного происхождения; в растительных продуктах он отсутствует. Благодаря этому витамину поддерживается нормальный процесс созревания эритроцитов у здорового человека.
В сутки взрослому человеку необходимо 3—5 мг витамина В12. Как показали современные исследования, витамин В12, попавший в организм с пищей, всасывается в кишечнике лишь при соединении его с особым белком — гастромукопротеином (который иначе называется «внутренний фактор»).
Гастромукопротеин вырабатывается у человека железами желудка и обладает способностью образовывать с витамином В12 комплексное соединение. Оказалось, что этот белок предохраняет витамин от пожирания микроорганизмами, заселяющими кишечник. Таким образом, он выступает в роли «проводника» витамина В12 и спасает его от разрушающего действия микробов.
Всосавшийся витамин накапливается в печени и затем используется для целей кроветворения по мере необходимости.
Установлено, что витамин B12 принимает активное участие в образовании соединений, являющихся составными частями нуклеиновых кислот, — тех самых кислот, коими так богаты ядра клеток и которые определяют основные наследственные признаки организма.
В случае нехватки витамина B12 задерживается синтез нуклеиновых кислот, в результате чего неизбежно нарушается деление постоянно размножающихся кроветворных клеток. Тогда в костном мозге вместо нормальных эритробластов появляются огромные, медленно созревающие клетки, получившие название мегалобластов (от греческого слова «мегалос» — огромный).
Где это происходит?
Гемопоэз встречается во многих местах:
Гемопоэз в эмбрионе
Иногда называемый примитивным гемопоэзом, кроветворение в эмбрионе приводит лишь к образованию эритроцитов, которые могут обеспечить развивающиеся органы кислородом. На данном этапе развития желточный мешок, питающий эмбрион до полного развития плаценты, контролирует кроветворение.
По мере развития эмбриона процесс кроветворения переходит в печень, селезенку и костный мозг и начинает производить другие типы кровяных клеток.
У взрослых гемопоэз красных кровяных телец и тромбоцитов возникает в основном в костном мозге. У младенцев и детей он может также продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывают лейкоциты, называемые лимфоцитами. Ткани печени, селезенки, лимфатических узлов и некоторых других органов вырабатывают другой тип лейкоцитов, называемый моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови для замены старых. Около 1 процента клеток крови тела должны быть заменены каждый день.
Лейкоциты имеют самую короткую продолжительность жизни, иногда выживая всего от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированной стволовой клетки. Эти стволовые клетки размножаются, и некоторые из этих новых клеток трансформируются в клетки-прекурсоры. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре разделяются и созревают на компоненты крови, такие как эритроциты и лейкоциты, или тромбоциты.
Хотя исследователи понимают основы гемопоэза, в настоящее время ведутся научные дискуссии о том, как формируются стволовые клетки, играющие определенную роль в кроветворном процессе.
Основные этапы производства крови в организме
Все этапы могут быть разделены по принципу того, какая клетка крови производится.
Производство эритроцитов
Эритроциты
Данный процесс осуществляется в 18 этапов. Самым первым этапом в дифференцировке является эритроцитарная единица (КОЕ-Э). Из нее развивается проэритробласт, который является самой первой клеткой предшественницей, которая самая первая находится в костном мозге. Через 5 делений проэритробласт теряет ядро и уже сам «плавает» в крови. Эритроцит живет около 120 дней.
Отработанные эритроциты редуцируются. При этом процесс равного разрушения и образования новых клеток должен строго контролироваться. Если у организма повышается нужда в эритроцитах, то их выработка ускоряется и наоборот.
В костном мозге может разрушаться часть эритроцитов. Нормальный уровень гемоглобина поддерживается в организме за счет гормонов и прочих веществ, оказывающих влияние на эритропоэз. Если вдруг клетка не завершила свое преобразование, процесс появления красных кровяных клеток считается неэффективным.
Производство лейкоцитов
Начальной единицей является миелобласт, после созревания которого происходят некоторые изменения. Ядро его уменьшается и миелобласт становится промиелоцитом. Такая клетка имеет маленькое ядро и уплотнения хроматина по периферии. Промиелоцит переходит в миелоцит.
Лейкоциты
Миелоциты по предназначению делятся на базофильные, эозинофильные и нейтрофильные. Со временем они становятся метамиелоцитами, которые переходят в гранулоциты палочкоядерного и сегментоядерного типа.
Палочкоядерные имеют ядро в виде колбаски. Ядро сужается и получается сегментоядерный гранулоцит. Все формы до миелоцита в норме можно обнаружить только в костном мозге, а палочки и сегменты находятся как в нем, так и в крови.
Стоит затронуть такие клетки, как моноциты. Начальной единицей является монобласт, который переходит в промоноцит, а затем и в моноцит. Зачем нужны моноциты полностью не ясно. Есть предположение наличия некой связи с гранулоцитами на генетическом уровне.
Клетки-макрофаги получаются при дальнейшей дифференцировке с образованием неровностей на их поверхности. Макрофаги связаны со многими клетками и имеют огромное количество функций:
- удаляют продукты распада
- являются звеном иммунитета
- необходимы в свертывании крови
- участвуют в обмене веществ
- стимулируют некоторые процессы
И конечно же, стоит упомянуть о лимфоцитах. В ходе своего преобразования лимфоциты проходят стадию клеток предшественниц Т и В лимфоцитов. Они заполняют селезенку, лимфоузлы. Такие клетки проходят дифференцировку от предшественников Т и В лимфоцитов до зрелых клеток. Регуляция этого процесса контролируется цитокинами.
Производство тромбоцитов
Начальным этапом производства тромбоцитов является стволовая клетка гемопоэтического типа. Основными этапами ее преобразований является:
- перевод клетки в нужное русло дифференцировки
- деление клеток путем митоза
- увеличение плоидности клетки
- рост цитоплазмы
- выход тромбоцитов в русло
На ранних стадиях тромбоцитопоэза основным регулятором служит тромбопоэтин. Сами тромбоциты активно участвуют в свертывании крови и регулируют спазм сосудов.
Вот так, пройдя множество преобразований, стволовая клетка становится одной из клеток кровяного русла.
I. Кровь — внутренняя среда организма. Состав и функции крови.
Состав.
Кровь
является
жидкой
тканью,
составляющей
внутренней
среды
организма,
которой
отводится
большая
роль
в
жизнедеятельности.
Общее
количество
крови
в
организме
человека
колеблется
в
пределах
1/11-1/13 общей
массы
тела
(около
7%) и
составляет
в
абсолютных
цифрах
4,5-5 литров.
Кровь
здорового
человека
состоит
на
55% из
жидкой
части
(плазмы)
и
на
45% представлена
различными
форменными
элементами
(гематокритное
число).
Удельный
вес
от
1050 до
1060, Рh
— слабощелочная
(Рh
— 7,4) близкая
к
нейтральной.
Жидкая
часть
крови
— плазма
(содержит
фибриноген,
сыворотка
без
него)
содержит
белки,
углеводы,
липиды,
гормоны,
витамины,
ферменты,
электролиты
(минеральные
вещества),
растворённые
газы,
промежуточные
продукты
обмена
веществ.
Клеточные
элементы
представляют:
эритроциты
(красные
кровяные
тельца),
лейкоциты
(белые
кровяные
тельца),
тромбоциты
(кровяные
пластинки,
самые
маленькие
элементы
крови).
Функции:
-
дыхательная
— перенос
О2
(кислорода)
к
тканям
и
органам
из
лёгких
и
вынос
из
них
для
выведения
из
организма
СО2
(углекислого
газа0; -
транспортная
(питательная)
— доставка
к
отдельным
частям
тела
и
органам
питательных
веществ; -
выделительная
(экскреторная)
— удаление
из
организма
конечных
продуктов
продукта
распада:
креатинин,
мочевина,
аммиак
и
т.д.; -
поддержание
постоянства
внутренней
среды
организма
(гомеостаза);
даже
самое
незначительное
колебание
кислотно-щелочного
равновесия
(нарушение
баланса
между
содержанием
кислоты
и
щёлочи
в
крови
в
ту
или
иную
сторону)
оказывает
влияние
на
активность
ферментов,
изменяется
скорость
биохимических
процессов;
изменение
кислотности
крови
(содержание
кислоты
и
щелочных
веществ)
при
Рh
выше
7,8 или
ниже
6,8 уже
несовместимо
с
жизнью; -
защитная
— иммунологические
реакции
(выработка
антител),
участие
в
фагоцитозе; -
способность
свёртываться
(образовывать
сгусток)
при
повреждении
сосуда.