Клетки иммунной системы
Содержание:
Аутоиммунные заболевания
Это группа таких заболеваний, которые имеют разные клинические проявления, связанные со сбоем иммунной системы. Иммунные клетки, вместо чужеродных агентов, начинают атаковать ткани различных органов. Учёными до конца не изученная причина подобных заболеваний. Клиническая картина зависит от пораженных органов и систем организма. Лечение производится препаратами, подавляющие иммунитет.
Причины возникновения аутоиммунных заболеваний
- Наследственная предрасположенность. Генная мутация.
- Способны спровоцировать вирусные и бактериальные инфекции. Когда патоген меняет клетки в организме. И иммунитет собственные клетки воспринимает патогенными.
- Аномальное развитие иммунной системы. Ошибочная работа клеток.
Все факторы, написанные ниже не означают, что вы заболейте аутоиммунным заболеванием. Это показатель склонности к таким заболеваниям. Большинство таких заболеваний протекают хронически. Для некоторых достаточно наладить работу иммунитета.
Пример распространенных заболеваний:
- Сахарный диабет – врождённый диабет 1 типа. Сахарный диабет такое заболевание, при котором поджелудочная железа не способна вырабатывать достаточно инсулина. Диабет невозможно излечить, но можно контролировать за с чёт лечебной диеты. Так же постоянного введения инсулина.
- Аутоиммунный гепатит – заболевание печени с неизвестной этиологией. Клиническая картина, как у хронического гепатита. Один из важных показателей именно этого заболевания – это его раннее появление, в период полового созревания.
- Болезнь Грейвса (диффузный токсический зоб) – по-другому называют Базедова болезнь. Характеризуется избыточной выработкой гормонов щитовидной железы. Клиническая картина – очень обширная и вызывает симптоматику у всех систем организма. От головной боли до нарушения сердечного ритма.
- Ревматоидный артрит – это хроническое заболевание поражающие суставы. Этиология до конца не изучена. При артрите организм вырабатывает антитела против здоровых клеток и тканей собственного организма. Пик заболеваемости в 40-65 лет, чаще встречается у женщин. Характеризуется болью в суставах (из-за разрушения костей и суставов), скованность суставов, общие недомогания.
Лейкоциты
Содержание лейкоцитов в организме человека может достигать 10% от веса человека. Иными словами – их невероятно много. Лейкоциты делятся на 5 основных категорий. Некоторые категории, в свою очередь, тоже имеют деление.
Лимфоциты
Говорят, что у человека падает иммунитет, когда он заболевает. И этому есть подтверждение: если такой пациент сдаст кровь на общий анализ, у него практически в 100% случаях обнаружится пониженное содержание лимфоцитов.
Это – основные клетки иммунной системы. Именно через них реализуется так называемая иммунологическая память.
Лимфоциты делятся на две группы: Т- и B-. Выделяют следующие подгруппы T-лимфоцитов:
- Т-хелперы. Их задача – контролировать деление клеток в организме. Они активируют деятельность моноцитов.
- Т-супрессоры. Если Т-хелпер слишком активен, Т-супрессор подавит его “слишком кипучую” деятельность.
- Т-киллеры. Убивают антигены
B-лимфоциты реагируют на активность антигена тем, что активируют свое преобразование в плазматические клетки. Те уже, в свою очередь, занимаются непосредственной выработкой антител.

B-лимфоциты, точно так же, как и их- Т-коллеги, делятся на группы:
- B1-лимфоциты являются непосредственными участниками гуморального иммунитета человека. Их “штаб-квартирой” являются лимфатические ткани кишечника. Они могут преобразовываться в плазмоциты.
- B2-лимфоциты берут свое начало из тканей костного мозга. Их присутствие заметно в селезенке, а также в лимфоузлах.
- B-лимфоциты памяти реализуют “иммунологическую память”. Если имеет место повторная атака патогена, именно B-лимфоциты памяти обеспечат наиболее быстрый ответ иммунной системы.
Моноциты
Если он в крови, это – моноцит. Если он в тканях организма, это – макрофаг. Вот такая удивительная двуликая клетка, функция которой невероятно важна: моноцит в прямом смысле слова пожирает патогена, считывает о нем всю информацию и специальными молекулами “сигнализирует” о полученных “знаниях” всем клеткам организма. Точно так же макрофаги уничтожают то, что организму не нужно: отмершие клетки, зараженные, токсичные и т.д.
Нейтрофилы
Знаете, почему клетки иммунной системы – нейтрофилы – именно так называются? Они нейтрализуют воспаление. Вообще они очень мало живут. Зарождаясь в костном мозге, они затем попадают в кровоток и ткани. Их задача – уничтожение бактерий путем заглатывания и нейтрализация воспалительных процессов в организме. Уникальность нейтрофилов состоит еще и в том, что эти клетки имеют возможность самостоятельно передвигаться по организму к месту воспаления. Им для этого не нужен сигнал от других клеток.
Эозинофилы
У аллергика повышаются (иногда в разы) эозинофилы. Реакция организма такова, что если в нем встречается специальный белок, вызывающий аллергию, и если таких белков много, то увеличивается количество клеток организма, ответственных за его нейтрализацию – эозинофилов.
Почему, когда мы говорим про клетки иммунной системы и их функции, мы также упоминаем эозинофилы, несмотря на то, что они, казалось бы, не имеют прямого влияния на иммунитет?
Ещё как имеют! Ведь аллергия – это тоже своего рода болезнь. А при любой болезни резко падает иммунитет. Задача эозинофилов – нейтрализовать аллерген в организме в кратчайшие сроки.

Внимание: если у вас по лейкоцитарной формуле общего анализа крови обнаруживается эозинофилия, это означает, что вам нужно искать источник аллергии в организме
Базофилы
У базофилов две функции: во-первых, они, за счет повышенного содержания гепарина, контролируют нормальную свертываемость крови, во-вторых – блокируют распространение потенциальных ядов по всему организму, “запирая” их в тканях.
Органы и клетки иммунной системы
Остановимся здесь кратко, так как это сугубо медицинская информация, ненужная простому человеку.
Красный костный мозг, селезенка и тимус (или вилочковая железа) – центральные органы иммунной системы. Лимфатические узлы и лимфоидная ткань в других органах (например, в миндалинах, в аппендиксе) – это периферические органы иммунной системы.
Запомните: миндалины и аппендикс – НЕ ненужные органы, а очень даже важные органы в организме человека.
Основная задача органов иммунной системы человека – выработка различных клеток.
Какие бывают клетки иммунной системы?
1) Т-лимфоциты. Делятся на различные клетки – Т-киллеры (убивают микроорганизмов), Т-хелперы (помогают распознавать и убивать микробов) и другие виды.
2) В-лимфоциты. Главная их задача – выработка антител. Это вещества, которые связываются с белками микроорганизмов (антигены, то есть инородные гены), инактивируют их и выводятся из организма человека, тем самым «убивая» инфекцию внутри человека.
3) Нейтрофилы. Эти клетки пожирают инородную клетку, разрушают ее, при этом также разрушаясь. В итоге появляется гнойное отделяемое. Характерный пример работы нейтрофилов – воспаленная рана на коже с гнойным отделяемым.
4) Макрофаги. Эти клетки также пожирают микробов, но сами не разрушаются, а уничтожают их в себе, либо передают на распознавание Т-хелперам.
5)Эозинофилы. Вырабатывают вещества, которые разрушают паразитов в организме человека. Характерное проявление работы эозинофилов – аллергическая реакция на гельминтов (на глисты).
Есть еще несколько клеток, которые выполняют узкоспециализированные функции. Но они интересны специалистам-ученым, а простому человеку достаточно тех видов, что указаны выше.
Пониженный иммунитет: причины и симптомы
С возрастом иммунитет способен снижаться. Это происходит под влиянием неблагоприятных факторов окружающей среды, вредных привычек, нездорового образа жизни. Ослабленный иммунитет уже не успевает отслеживать всех возбудителей заболеваний, проникших в организм, и своевременно убивать их. Так развиваются острые и хронические заболевания, ускоряются процессы старения.
К причинам, влияющим на снижение иммунитета, относят:
- Отсутствие режима дня, несоблюдение баланса между трудом и отдыхом, недостаток сна.
- Плохую экологию.
- Частые или длительные стрессы.
- Несбалансированное питание: скудный рацион, слишком жесткие диеты, голодания.
- Вредные привычки: злоупотребление кофе или алкоголем, курение.
- Недостаток витаминов и минералов.
- Злоупотребление медикаментозными препаратами (они оказывают на организм токсическое воздействие).
- Травмы, включая ожоги.
- Тяжелые физические нагрузки.
- Недавние операции.
Симптомами ослабленного иммунитета являются:
- Подверженность частым простудным заболеваниям (чаще 3 раз в год).
- Повышенная утомляемость.
- Нарушения сна, чувство усталости уже сразу после пробуждения.
- Вялость, слабость.
- Разбитое состояние.
- Герпесные высыпания.
- Частые воспалительные патологии полости рта (например, стоматит).
- Фурункулез.
- Субфебрильная (до 38 градусов) температура тела на протяжении долгого времени.
- Гнойные воспаления потовых желез.
- Частые и длительные (более 14 дней) обострения гайморита или бронхита.
- Нарушения функций ЖКТ.
- Инфекционные заболевания половых органов (микоплазмоз, хламидиоз, уреаплазмоз), лечение которых затруднено и растягивается на длительный период.
- Рецидивирующие и хронические патологии.
- Аллергические реакции, которых не было ранее.
- Аутоиммунные заболевания.
- Раковые опухоли.
Важно! При наличии симптомов снижения иммунитета необходимо обязательно обратиться к врачу. В противном случае могут развиться иммунодефицитные состояния (снижение активности гуморального и клеточного иммунитета)
Механизмы функционирования иммунитета
Условно все механизмы функционирования иммунитета можно подразделить на специфические и неспецифические.
Специфический иммунитет
Основу специфического иммунного ответа составляет работа антител (гуморальный иммунитет) и клеток (клеточный иммунитет). Именно специфический иммунитет формирует иммунологическую память, обеспечивает более быструю и мощную реакцию организма на антиген, попавший в него повторно.
Механизм действия клеточного иммунитета заключается в том, что Т-лимфоциты на своих мембранах несут рецепторы соответствующих биоактивных веществ и распознают иммуноген. После клонирования образуется целая армия Т-лимфоцитов, которые атакуют и уничтожают чужеродные клетки.
В-лимфоциты, ответственные за гуморальный иммунитет, тоже умеют обнаруживать в организме антигены. После распознавания чужеродной субстанции В-лимфоциты синтезируют соответствующие антитела и выделяют их в кровь. Антитела нейтрализуют потенциально опасные для организма клетки или же связываются с ними в единый прочный комплекс «антиген-антитело», обеспечивая его захват фагоцитами.
Т- и В-лимфоциты вырабатываются у плода уже с 12-й недели. В организме новорожденного их концентрация гораздо больше, чем в теле взрослого человека. Однако лимфоциты ребенка менее активны, поскольку первые 3-6 месяцев после рождения его организм продолжает находиться под защитой материнского (индивидуального) иммунитета.
Неспецифический иммунитет
К неспецифическим механизмам защиты относятся фагоцитарная реакция и система комплемента.
Особые лейкоциты в теле человека (моноциты, макрофаги, нейтрофилы) способны поглощать чужеродных агентов и комплексы «антиген-антитело». Такой процесс получил название «фагоцитоз» или «фагоцитарная реакция». Получая сигнал о наличии в организме антигенов, фагоцитарные лейкоциты устремляются к ним на скорости до 2 мм/ч, обволакивают, инактивируют и втягивают внутрь своей протоплазмы. После чего переваривают чужеродного агента с использованием специальных ферментов.
В процессе борьбы с антигенами часть лейкоцитов может погибнуть. Такие погибшие клетки образуют гной и выделяют вещества, провоцирующие воспалительные процессы в тканях. Однако такое воспаление тоже является механизмом иммунитета, активирующего в ответ защитные реакции всего организма, направляющего к месту воспалительной реакции дополнительные лейкоциты.
Систему комплемента позвоночных организмов составляют более 25 видов белков, которые помечают чужеродные клетки, указывая фагоцитам на объекты, подлежащие поглощению.
Кроме того, функцию неспецифической защиты организма человека выполняют слизистые оболочки и кожа, ферменты ЖКТ и ротовой полости, здоровая микрофлора.

Антитела
Это Y-образные белки, каждый из которых реагирует на определенный антиген (бактерию, вирус или токсин). Каждое антитело имеет специальный участок (на концах двух ветвей Y), который чувствителен к определенному антигену и каким-то образом связывается с ним.
Когда антитело связывается с токсином, оно называется антитоксином. Связывание обычно отключает химическое действие токсина.
Когда антитело связывается с внешней оболочкой вируса или клеточной стенкой бактерии, оно может остановить их движение через стенки клеток организма, или большое количество антител может связываться с захватчиком и сигнализировать системе комплемента, что захватчик должен быть удален.
Антитела бывают пяти классов:
- Иммуноглобулин А (IgA)
- Иммуноглобулин D (IgD)
- Иммуноглобулин Е (IgE)
- Иммуноглобулин G (IgG)
- Иммуноглобулин М (IgM)
Всякий раз, когда вы увидите аббревиатуру, подобную IgE, в медицинском документе, вы теперь сможете понять, что то, о чем они говорят, является антителом.
Не только антитела
У большинства переболевших COVID-19 есть антитела к вирусу. Но у части пациентов эта иммунная реакция полностью отсутствует. Уничтожение вируса в их организме могло произойти за счет другой части иммунной системы — Т-лимфоцитов, или Т-клеток. У большинства инфицированных эти клетки действительно способны распознавать фрагменты вируса, показало исследование ученых из ФГБУ «НМИЦ гематологии» Минздрава России. Более того, выяснилось, что у людей, которые не болели COVID-19, тоже встречаются Т-клетки, которые реагируют на SARS-CoV-2.
Тело без антитела
 Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
Фото: ИЗВЕСТИЯ/Зураб Джавахадзе
В своем исследовании ученые описали два типа иммунного ответа на новый коронавирус: антитела и Т-клеточный ответ. Они рассматривали биоматериалы переболевших COVID-19 (31 образец), не болевших (14), а также образцы из биобанка, которые были взяты еще до пандемии (10). Оказалось, что в крови, взятой весной-2020 у тех, кто не перенес COVID-19, значительно больше Т-клеток, узнающих вирус, чем в образцах из биобанка. Авторы исследования объясняют это так: среди тех, кто не заболел, некоторые, вероятно, всё равно успели столкнуться с вирусом.
— Мы не до конца понимаем природу этого иммунного ответа, — рассказала «Известиям» первый автор статьи, участник грантов РНФ, сотрудник Национального медицинского исследовательского центра гематологии Алина Шомурадова. — Т-клеточный ответ может наблюдаться из-за того, что активируются клетки иммунологической памяти на другие коронавирусы, которые существовали вокруг нас и до 2019 года. Или, например, эти люди на самом деле перенесли COVID-19 бессимптомно и не выработали антитела к вирусу.
При этом не болевшими в работе считали тех, у кого был отрицательный результат ПЦР-теста, подчеркнули исследователи. То есть нельзя исключить того, что на самом деле количество переболевших может быть значительно выше официальных данных.
Нейтрофилы
Первое самое многочисленное звено защитных клеток представлено нейтрофилами. Их популяция составляет около семидесяти процентов от числа всех лейкоцитарных тел, при этом молодые нейтрофилы палочкоядерного типа — полтора процента, а остальные зрелые виды.
Нейтрофильные тельца — это полиморфоядерные гранулоцитарные представители лейкоцитов, имеющие ядро состоящее из сегментов. Они являются представителями фагоцитов. В осуществлении фагоцитарной функции действуют как микрофаги, и способны распознавать, прикрепляться и поглощать мелкие патогенные частицы. Закончив фагоцитоз, нейтрофилы погибают, производя дегрануляционные процессы и усиливая миграцию иммунных клеток в очаг инфекции.
Нейтрофилы выполняют иммунологические функции в борьбе с болезнетворными бактериями и грибками, принимают участие в противовирусном ответе, а в противопаразитарном и противоопухолевом иммунитете не участвуют.
Изменение уровня нейтрофилов в крови говорит о наступлении иммунных реакций на проникновение бактериальных и других инфекций, но при хронических заболеваниях их уровень остается в пределах нормы.
Понятие и виды иммунитета
Понятие иммунитет произошло от латинского «immunis». Его значение еще до нашей эры медики понимали как «находящийся под хорошей защитой, устойчивый к заразной болезни».
Иммунная система (иммунитет) – естественный защитный механизм нашего организма. Иммунитет поддерживает постоянство внутренней среды, устраняет чужеродное воздействие инфекционных возбудителей, химических веществ, аномальных клеток и т.д.
Иммунитет отвечает за два важнейших процесса в организме:
1) замена отработавших или поврежденных, состарившихся клеток различных органов нашего тела;
2) защита организма от проникновения разного рода инфекций – вирусов, бактерий, грибков.
Когда в организм человека вторгается инфекция, в дело вступают защитные системы организма, задача которых – обеспечить целостность и функциональность всех органов и систем. Макрофаги, фагоциты, лимфоциты – это клетки иммунной системы, иммуноглобулины – это белки, которые вырабатываются клетками иммунной системы и также борются с чужеродными частицами.
Другими словами, иммунитет – это:
· невосприимчивость организма к инфекциям;
· способность удалять из организма любой чужеродный материал (бактерии, вирусы, нетипичные (опухолевые) клетки).
Существует два вида иммунитета:
1. специфический иммунитет приобретается после инфекции (например после гриппа, кори, краснухи) или вакцинации. Он носит индивидуальный характер и формируется на протяжении всей жизни человека в результате контакта его иммунной системы с различными микробами и антигенами. Специфический иммунитет сохраняет память о перенесенной инфекции и препятствует ее повторному возникновению. Иногда специфический иммунитет может сохраняться на всю жизнь, иногда — несколько недель, месяцев или лет;
2. неспецифический (врожденный) иммунитет – врожденная способность уничтожать все чуждое организму. Это образованная во внутриутробной жизни способность клеток синтезировать мембранные рецепторы к антигенам других организмов, других тканей и некоторым микроорганизмам, а также синтезировать соответствующие антитела и выводить их в жидкости тела.
Во время внутриутробного онтогенеза происходит коммитирование всех клеток, в том числе клеток крови, к антигенам другого организма т к антигенам других тканей.
Поэтому главной частью врожденного иммунитета является приобретение мембранами клеток молекул-рецепторов, способных связываться с определенными молекулами, фиксированными или продуцируемыми клетками других организмов (материнского), а также собственными клетками других органов и тканей. Эту часть врожденного иммунитета (иммунного статуса) называют главным комплексом гистосовместимости.
Ожирение и диета способны помогать раку
В новом исследовании на мышах ученые Гарвардской Медицинской школы обнаружили новый фрагмент этой головоломки, с огромными последствиями для иммунотерапии рака: ожирение позволяет раковым клеткам превзойти убивающие опухоль иммунные клетки CD8+ в битве за энергию.
В своих выводах исследовательская группа показывает, что диета с повышенным содержанием жиров снижает количество и противоопухолевую активность иммунных CD8+ Т-клеток. Эти клетки, являясь частью иммунной системы, считаются критически важными для сдерживания роста злокачественных опухолей. И эти CD8+ клетки проникают внутрь опухолей для подавления рака.
Как показали эксперименты, при диете с повышенным содержанием жиров раковые клетки перепрограммируют свой метаболизм в ответ на повышенную доступность жира, чтобы лучше поглощать богатые энергией жиры, лишая иммунные Т-клетки топлива и ускоряя рост опухоли.
“Формирование одной и той же опухоли в условиях ожирения и при его отсутствии показывает, что раковые клетки перестраивают свой метаболизм в ответ на диету с высоким содержанием жиров“, – отметила Марсия Хейгис, профессор клеточной биологии в Институте Блаватника, соавтор исследования. “Наше открытие показывает, что противораковая терапия, которая потенциально будет работать в одной ситуации, может быть не столь эффективной в другой, и это необходимо лучше понять, учитывая эпидемию ожирения в нашем обществе.”
 Изменение активности иммунных CD8+ T-клеток в зависимости от ожирения и количества жира в диете
Изменение активности иммунных CD8+ T-клеток в зависимости от ожирения и количества жира в диете
Команда ученых обнаружила, что блокирование, связанного с жиром метаболического перепрограммирования раковых клеток, значительно уменьшило объем опухоли у мышей, которые находились на диете с большим количеством жира в питании. CD8+ Т-клетки являются основным оружием современной иммунотерапии, которая активирует иммунную систему против рака, поэтому результаты этого исследования предполагают новые стратегии улучшения такой терапии.
“Иммунотерапия рака оказывает огромное влияние на жизнь пациентов, но она не приносит пользы всем“, – сказала другой соавтор исследования Арлин Шарп, профессор сравнительной патологии и заведующая кафедрой иммунологии Института Блаватника им.Джорджа Фабиана. “Теперь мы знаем, что существует метаболическое перетягивание каната между иммунными Т-клетками и опухолевыми клетками, которое меняется с ожирением“.
Ученые изучали влияние ожирения на мышиные модели различных типов рака, включая колоректальный рак, рак молочной железы, меланому и рак легких. Команда давала мышам нормальную пищу или с большим количеством жира, что приводило к увеличению массы тела и другим изменениям, связанным с ожирением. Затем они изучили различные типы клеток и молекул внутри и вокруг опухолей, которые вместе называются микроокружением опухоли.
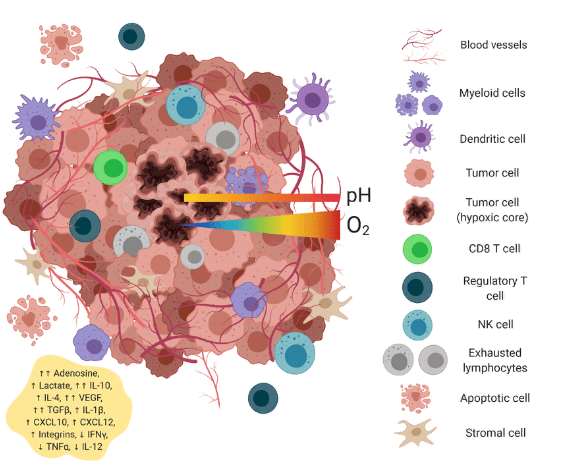 Иммунные CD8+ Т-клетки в микроокружении опухоли (источник)
Иммунные CD8+ Т-клетки в микроокружении опухоли (источник)
Типы вакцины
Вакцины можно разделить на два основных типа.
1. Живые аттенуированные вакцины
Эти вакцины содержат «ослабленные» целые бактерии или вирусы, которые вызывают защитный иммунный ответ, но не вызывают заболевание у здоровых людей.
Исследователи разработали ослабленные штаммы бактерий или вирусов. Аттенуированные вакцины вызывают инфекцию, но не дают полного набора признаков и симптомов заболевания, потому что инфекционный агент размножается только до ограниченного распространения в организме и никогда не возвращается к вирулентной форме.
Вирулентность — это степень патогенности (ядовитости) инфекционного агента по отношению к организму человека или животного в естественных условиях.
Использование таких живых микробов обеспечивает наиболее эффективную профилактику, так как они действительно имитируют легкую форму естественной инфекции. Таковы вакцины против желтой лихорадки, полиомиелита (пероральная вакцина), кори, краснухи и туберкулеза. Хотя живые вакцины достаточно ослаблены в отношении здоровых людей, они могут вызвать полное заболевание у людей, страдающих иммунодефицитом.
2. Инактивированные вакцины
Эти вакцины содержат целые бактерии или вирусы, которые были убиты, или небольшие их фрагменты или части, такие как белки или полисахариды, которые не могут вызвать заболевание. Существует несколько различных их типов, которые описаны ниже.
Инактивированные вакцины имеют несколько видов:
- Содержащие целые убитые вирусы.
- Субъединичные вакцины или «бесклеточные».
Большинство вакцин — это субъединичные фракции, которые вообще не содержат целых бактерий или вирусов. «Бесклеточный» означает, что вакцина не содержит целых клеток. Вместо этого они содержат полисахариды (сахара) или белки с поверхности бактерий или вирусов. Эти полисахариды или белки являются частями чужеродных организмов, которые наша иммунная система распознает как антигены.
Несмотря на то, что вакцина может содержать лишь несколько из тысяч белков бактерии, их самих по себе достаточно, чтобы вызвать иммунный ответ, который может защитить от болезни, вызываемой этой бактерией.
Существует несколько различных типов субъедининичных вакцины:
Вакцины на основе анатоксина
Некоторые бактерии выделяют токсины (ядовитые белки), когда они атакуют организм. Иммунная система распознает эти токсины точно так же, как она распознает полисахариды или белки на поверхности бактерий. На основе этого факта производят вакцины с инактивированными версиями этих токсинов. Их называют «анатоксинами», потому что они похожи на токсины, но не ядовиты. Они вызывают сильный иммунный ответ.
Конъюгированная вакцина или присоединенная
Смысл ее в том, что полисахариды капсулы клетки бактерии соединяются с белком того или иного антигена, и тем самым усиливают иммунный ответ.
Например, в полисахарид какой-то бактерии присоединяется к белку дифтерийного или столбнячного анатоксина. Иммунная система распознает эти белки очень легко, и это помогает генерировать более сильный иммунный ответ на полисахарид. Дифтерийный анатоксин часто называют «белком-носителем CRM197».
Рекомбинантная вакцина
Рекомбинантные вакцины изготавливаются с использованием бактериальных или дрожжевых клеток. Из вируса или бактерии, от которых мы хотим защититься, берется маленький фрагмент ДНК. Его вводят в другие клетки, чтобы заставить их произвести большое количество активного ингредиента (от вируса или бактерии) для вакцины (обычно только один белок или сахар).
Технология рекомбинантной ДНК позволила исследователям использовать модифицированные бактерии и вирусы, которые не вредны для человека, для иммунизации индивидуумов против антигена патогенного микроорганизма. Этот подход предполагает введение в ДНК безвредного микроорганизма ген патогенного организма, кодирующего антиген, способный вызвать защитный иммунный ответ, но не полноценное заболевание.
После прививки в организм хозяина микроорганизм вырабатывает защитный антиген возбудителя и иммунизирует хозяина. На основе этого подхода была разработана эффективная пероральная вакцина против холеры.
Комплемент
Это не клетки, а группа белков, содержащихся в крови, представляющих самый мощный из гуморальных факторов иммунной системы. Поскольку белки состоят из аминокислот, то и комплемент состоит также из аминокислот. Они инициируют защитные реакции при встрече с опасностью.
Как только комплемент обнаруживает чужеродный микроорганизм, он обволакивает его и пробивает бреши в его клеточной мембране, вызывая этим гибель микроорганизма. При этом комплемент выделяет вещества, которые воспринимаются как сигнал тревоги по всему организму. Этим явлением обусловлено покраснение вокруг места проникновения инфекции.
Книги по укреплению иммунитета
Чтобы детально исследовать понятие иммунной системы и способы его укрепления, издаются тематические работы от известных авторов. Среди самых популярных:
- Умнякова Екатерина, «Как работает иммунитет»; 2018 год, издательство «Аванта». В книге Умняковой Е. излагается научное представление об иммунной системе, процессах в организме. Также автор развеивает устоявшиеся мифы, а с помощью простых аналогий и примеров из жизни доступно объясняет о всех процессах, связанных с иммунной системой человека.
-
Фурман Джоэл, «Нетрадиционная медицина и народная кулинария»; 2013 год, издательство Эксмо.
Недоспасов С. А., «Врожденный иммунитет и его механизмы»; 2012 год, издательство Научный мир.