Как работают бактериофаги
Содержание:
Краткое описание технологического процесса
Производственный процесс включает следующие основные этапы: работа с возбудителями гнойно-септических и кишечных бактериальных инфекций, подбор к ним активных фаговых рас, работа с коллекцией производственных бактериальных штаммов, регулярно пополняемых свежевыделенными бактериями.
Культивирование бактериофагов проводят в реакторах (ферментерах) путем посева производственных штаммов бактерий и маточных фагов, содержащих несколько высокоактивных фаговых рас. После завершения процесса фаголизиса для очистки фаголизатов от фрагментов бактериальных клеток, их метаболитов, в том числе энтеротоксинов и белковых компонентов питательной среды, культуральную суспензию пропускают через микрофильтрационные установки. Полученный фаголизат подвергают ультрафильтрации и концентрированию с последующей стерилизующей фильтрацией. Далее из полученного стерильного концентрата фаголизатов готовят жидкий препарат путем разведения 0,9 % раствором натрия хлорида со стабилизаторами или получают лиофилизированную биомассу, предназначенную для получения таблеток (лиофилизируя концентрат фаголизатов при соответствующих условиях).
В процессе производства бактериофагов оценивают качество исходных, промежуточных и окончательных продуктов на следующих основных этапах и тестах.
- Подготовка производственных штаммов бактерий – контроль посевных культур бактериальных штаммов-продуцентов:
а) на чистоту;
б) типичность биологических свойств;
в) на отсутствие лизогении.
- Подготовка маточных бактериофагов – контроль маточных бактериофагов:
а) на содержание фаговых частиц в 1 мл, определяемое методом агаровых слоев по Грациа;
б) на специфическую активность, определяемую титрованием в жидкой питательной среде по методу Аппельмана на посевных бактериальных штаммах;
в) на стабильность лизиса (сохранность полученных результатов лизиса по методу Аппельмана) в течение 48 ч инкубации при температуре (37 ± 1) оС;
г) на стерильность.
В завершающей стадии культивирования в реакторах наступление полного фаголизиса определяют визуально по отсутствию видимого бактериального роста.
По мере завершения очистки фаголизатов методом ультрафильтрации, концентрирования и стерилизующей фильтрации проводится определение следующих показателей: рН, стерильность, специфическая активность по методу Аппельмана, аномальная токсичность.
При производстве комбинированных препаратов готовые монофаги соединяют в реакторах при соблюдении асептических условий.
Для получения жидкого препарата после финальной стадии бактериофаг разливают по флаконам и укупоривают.
Для получения препаратов в таблетках:
а) в концентрированный бактериофаг добавляют стабилизаторы и лиофилизируют. Сухую массу бактериофага контролируют в тестах на специфическую активность и микробиологическую чистоту;
б) после добавления наполнителей проводится таблетирование. В качестве вспомогательных веществ используют пектин, кальция глюконат, глюкозу, тальк, кальция стеарат. Таблетки проверяют на ломкость, отсутствие дефектов (сколов, расслоений), определяют среднюю массу таблеток;
в) после завершения фасовки таблеток готовый продукт контролируют по всем показателям: описание (внешний вид таблеток), подлинность и специфическая активность, средняя масса таблетки, распадаемость, потеря в массе при высушивании, микробиологическая чистота, аномальная токсичность.
К специфическим методам исследования, используемым для характеристики лечебно-профилактических бактериофагов, относятся методы Аппельмана и Грациа.
Требования к производственным штаммам
Производственные штаммы бактерий-продуцентов бактериофагов выделяют от больных гнойно-септическими или кишечными инфекциями и получают из бактериологических диагностических лабораторий (желательно расположенных в регионах реализации и потребления лечебно-профилактических бактериофагов). Коллекция производственных штаммов бактерий, используемых в производстве бактериофагов, должна ежегодно обновляться свежевыделенными штаммами от больных не менее чем на одну треть.
Производственные штаммы бактерий должны обладать типичными для каждого вида морфологическими, культуральными, биохимическими и антигенными свойствами, не продуцировать энтеротоксины и не содержать умеренных бактериофагов в своем геноме.
Производственные штаммы бактерий должны лизироваться маточными фагами по методу Аппельмана в титрах не менее чем на 1-2 порядка выше показателей специфической активности конечного продукта. При этом стабильность лизиса должна сохраняться после (48 ± 3) ч инкубирования при температуре 37 оС.
Производственные штаммы бактерий хранят в специальных изолированных помещениях в лиофилизированном состоянии в ампулах при температуре 2 — 8 оС в течение 10 лет и в пробирках с 0,4 — 0,7 % агаризованной питательной средой (на основе гидролизата Хоттингера или МПБ) под стерильным вазелиновым маслом при температуре 2 — 8 оС не более 1 года при регулярном пересеве каждые 2 — 3 мес.
Контрольные штаммы бактерий. При определении специфической активности готовых препаратов бактериофагов в качестве контрольных отбирают штаммы из коллекции производственных штаммов бактерий. Они не должны использоваться при производстве данной серии препарата.
Маточные бактериофаги. Для получения фаговых препаратов используются только вирулентные бактериофаги. Их выделяют из природных источников – клинического материала, сточных вод, почвы, пассируя на штаммах гомологичных видов бактерий – свежевыделенных и производственных. Подбирают высоко активные расы (штаммы) фагов к слаболизирующимся и фагорезистентным штаммам бактерий. Пополнение производственных фаговых рас различными штаммами из природных источников позволяет преодолевать первичную фагоустойчивость возбудителей.
Маточные бактериофаги должны включать только вирулентные фаги с широким диапазоном действия по отношению к штаммам гомологичного вида бактерий, обладать высокой активностью, стабильностью лизиса, специфической направленностью антимикробного действия и высокой «урожайностью». Характеристика кандидатных фаговых рас (штаммов) при отборе может быть дополнена электронно-микроскопическим изучением их морфологии и другими современными молекулярно-биологическими методами (например, методом секвенирования – определения последовательности фаговой ДНК). Хранение производственной коллекции бактериофагов осуществляется на гомологичных бактериальных штаммах при температуре от 2 до 8 оС в течение 5 лет с ежегодным пересевом.
Работа с производственными штаммами бактерий и бактериофагов, а именно регулярное пополнение производственных бактериальных штаммов за счет клинических изолятов и подбор к ним фаговых рас из природных источников, обеспечивает возможность адаптации лечебно-профилактических бактериофагов к циркулирующим возбудителям бактериальных инфекций. Таким образом, возможен выпуск производственных серий бактериофагов целевого назначения. Например, при вспышке или в очаге инфекции, обусловленной фагоустойчивым возбудителем, передача на производство эпидемически значимого бактериального штамма позволит адаптировать препарат из бактериофагов к конкретным эпидемиологическим условиям.
Диапазон действия лечебно-профилактических бактериофагов, их активность в отношении современных возбудителей бактериальных инфекций во многом зависят от организации сбора клинических штаммов.
Фаговый дисплей
В наши дни бактериофаги широко применяются также в качестве простых систем для наработки белков с заданными свойствами. Речь идет о разработанной в 1980-х гг. крайне эффективной молекулярно-селекционной методике — фаговом дисплее. Этот термин был предложен американцем Дж. Смитом, который доказал, что на основе бактериофагов кишечной палочки можно создать жизнеспособный модифицированный вирус, несущий на своей поверхности чужеродный белок. Для этого в фаговый геном внедряется соответствующий ген, который сливается с геном, кодирующим один из поверхностных вирусных белков. Такие модифицированные бактериофаги можно выделить из смеси с фагами дикого типа благодаря способности «чужого» белка связываться со специфичными антителами (Smith, 1985).
Из экспериментов Смита последовало два важных вывода: во-первых, используя технологию рекомбинантных ДНК, можно создавать огромные по разнообразию популяции численностью 106–1014 фаговых частиц, каждая из которых несет на своей поверхности разные варианты белков. Такие популяции назвали комбинаторные фаговые библиотеки. Во-вторых, выделив из популяции конкретный фаг (например, обладающий способностью связываться с определенным белком или органической молекулой), можно этот фаг размножить в бактериальных клетках и получить неограниченное число потомков с заданными свойствами.
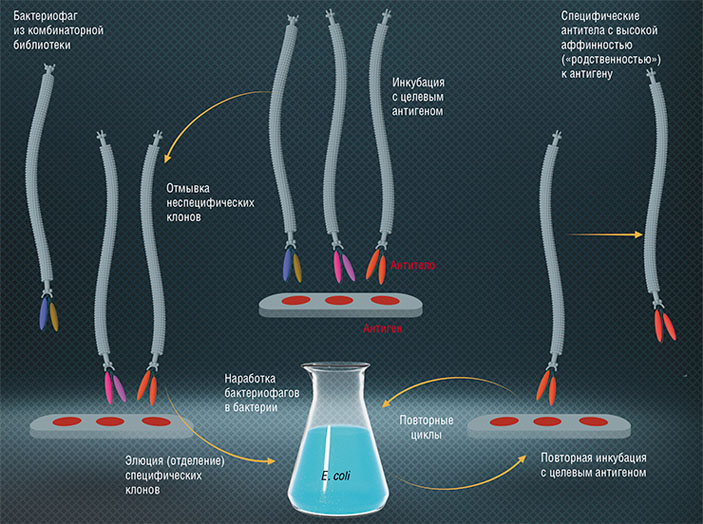
С помощью фагового дисплея сегодня производят белки, которые могут избирательно связываться с терапевтическими мишенями, например, экспонированные на поверхности фага М13, способные узнавать и взаимодействовать с опухолевыми клетками. Роль этих белков в фаговой частице заключается в «упаковке» нуклеиновой кислоты, поэтому они хорошо подходят для создания препаратов генотерапии, только в этом случае они формируют частицу уже с терапевтической нуклеиновой кислотой.
На сегодня можно выделить два основных направления применения фагового дисплея. Технология на основе пептидов используется для исследования рецепторов и картирования сайтов связывания антител, создания иммуногенов и нановакцин, а также картирования сайтов связывания субстратов у белков-ферментов. Технология на основе белков и белковых доменов — для отбора антител с заданными свойствами, изучения белок-лигандных взаимодействий, скрининга экспрессируемых фрагментов комплементарной ДНК и направленных модификаций белков.
С помощью фагового дисплея можно вносить узнающие группировки во все виды поверхностных вирусных белков, а также в основной белок, формирующий тело бактериофага. Вводя в поверхностные белки пептиды с заданными свойствами, можно получить целый спектр ценных биотехнологических продуктов. Например, если этот пептид будет имитировать белок опасного вируса или бактерии, узнаваемый иммунной системой, то такой модифицированный бактериофаг представляет собой вакцину, которую можно просто, быстро и безопасно наработать.
Если же концевой поверхностный белок бактериофага «адресовать» на раковые клетки, а к другому поверхностному белку присоединить репортерные группы (например, флуоресцирующие или магнитные), то получится средство для обнаружения опухолей. А если к частице присоединить еще и цитотоксический препарат (а современная биоорганическая химия позволяет легко это сделать), то получится лекарство, направленно действующее на раковые клетки.
Одним из важных применений метода фагового дисплея белков является создание фаговых библиотек рекомбинантных антител, где антигенсвязывающие фрагменты иммуноглобулинов расположены на поверхности фаговых частиц fd или М13. Особый интерес представляют библиотеки антител человека, поскольку такие антитела могут быть использованы в терапии без ограничения. В последние годы только на фармацевтическом рынке США продается около полутора десятка терапевтических антител, сконструированных с использованием этого метода.
Диагностическая и терапевтическая роль фагов
Фаги могут применяться в качестве диагностических препаратов для установления рода и вида бактерий, выделенных в ходе бактериологических исследования. Однако чаще всего их используют для лечения и профилактики некоторых инфекционных заболеваний (перорально или местно). Активность фага выражают числом частиц фага, содержащихся в 1 мл или 1 таблетке. Лечебное и профилактическое действие фагов основано на их литической активности.
Отличительной чертой бактериофагов как терапевтических средств является почти полное отсутствие у них побочного действия, что позволяет назначать эти препараты различным возрастным группам без каких-либо ограничений, и возможность назначения поливалентных бактериофагов до получения результатов бактериологического исследования. Препараты диагностических бактериофагов вводить категорически запрещается. В настоящее время в России для фаготерапии и фагопрофилактики производятся и используются:
- поливалентный сальмонеллезный бактериофаг;
- моновалентные бактериофаги — брюшнотифозный, дизентерийный, протейный, синегнойный, холерный, стафилококковый, стрептококковый, коли-фаг (кишечной палочки);
- комбинированные препараты поливалентных бактериофагов — колипротейный, пиобактериофаг (включающий стафилококковые, стрептококковые, клебсиеллезные, эшерихиозные, протейные и синегнойные бактериофаги) и др.
Показания для назначения
При различных гнойных и воспалительных патологиях рекомендуется использовать для лечения бактериофаг поливалентный. Отзывы, инструкция лекарства предупреждают пациентов о том, что принимают его только по назначению специалиста. Показаниями для назначения служат следующие патологические состояния:
- заболевания ЛОР-органов (трахеит, бронхит, отит, ангина, ларингит);
- воспалительные процессы в мочеполовой системе (пиелонефрит, цистит, кольпит, аднексит, уретрит);
- заболевания кожи, осложненные вторичной бактериальной инфекцией;
- инфекции пищеварительного тракта (дисбактериоз, холецистит);
- абсцессы, ожоги, фурункулы, карбункулы, флегмона;
- офтальмологические патологии (конъюнктивит, гнойные инфекции).
Такие же показания к применению имеет и схожий по составу препарат – бактериофаг комплексный. Инструкция разрешает применять его также для профилактики инфекций после хирургического вмешательства. В период лечения необходимость дополнительного применения пробиотиков отсутствует. Пиобактериофаги подходят для лечения вялотекущих бактериальных инфекций.
Общие данные
Прежде чем рассмотреть представителей вирусов – бактериофагов, — ознакомимся с общими сведениями о данном царстве таксономической иерархии.
Вирусная частичка имеет мельчайшие размеры (20-300 нм) и симметричное структурирование. Строится из постоянно повторяющихся компонентов. Все организмы вирусной природы являются фрагментом РНК или ДНК, заключаются в особую оболочку из белка, называемую капсидом. Они не обладают способностью самостоятельно функционировать и поддерживать жизнедеятельность, находясь вне другой клетки. Проявление свойств живых существ им присуще лишь после внедрения в другой организм, при этом сам вирус будет использовать ресурсы захваченной им клетки для поддержания стабильности в собственном состоянии. Из этого следует, что данный домен таксономии представлен в виде паразитической, внутриклеточной формы жизни. Существуют вирусы, захватывающие участки мембран клетки, в которой они развивались и жили. Они образуют вокруг таких мест еще одну оболочку, покрывающую капсид.

Как правило, вирусы образуют связь с поверхностью клетки, в которой они паразитируют. Далее вирус проникает внутрь и начинает поиск конкретной структуры, которую он способен поразить. Например, возбудители гепатита функционируют и обитают лишь в клеточных единицах печени, а паротит старается проникнуть в околоушные железы.
ДНК (РНК), принадлежащая вирусу, попав внутрь клетки-носителя, начинает взаимодействовать с аппаратом генетической наследственности так, что сама клетка начинает неконтролируемый процесс синтеза специфического ряда белков, зашифрованных в нуклеиновой кислоте самого возбудителя болезни. Далее происходит репликация, выполняемая непосредственно уже самой клеткой, и таким образом начинается процесс сборки новой вирусной частички.
Взаимодействие бактериофага с бактериальными клетками
Адсорбция бактериофагов на поверхности бактериальной клетки
По характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги.
Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла. Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки.
Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остаётся снаружи. Инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние (ДНК-полимеразы, нуклеазы) и поздние (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза) белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц.
Продолжительность этого процесса может составлять от нескольких минут до нескольких часов. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги.
Иногда фаг инициирует лизирующий цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определённых условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фага оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют лизирующей реакции.
Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определённого вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов.
Фармакодинамика и фармакокинетика
Что такое Бактериофаг?
Данный препарат является относительно новым на рынке лекарственных средств и у многих пациентов возникает закономерный вопрос: «Бактериофаг — что это такое?»
Бактериофаги – это вирусные частицы, убивающие только определенные виды болезнетворных бактерий. На их основе создаются соответствующие препараты. Открытие препаратов принадлежит канадскому ученому Феликсу Д’Эрелю.
Строение Бактериофагов
Обычный бактериофаг состоит из хвоста и головки. Хвост обычно в 3-4 раза длиннее диаметра головки. В головке располагается двуцепочечная или одноцепочечная РНК или ДНК с неактивной транскриптазой, окружённая оболочкой из протеина или липопротеина называемой капсидом.
Размножение Бактериофагов
Как и у обычных вирусов, цикл размножения у литических бактериофагов можно условно разделить на адсорбцию фага на стенке клетки, введение ДНК, воспроизведение фага и эвакуацию дочерних популяций из клетки.
Прикрепление фага к клетке бактерии происходит благодаря ее поверхностным структурам, служащим специфическими рецепторами для вирусов. Помимо рецепторов, присоединение фага зависит от температуры, кислотности среды, наличия катионов и ряда других соединений. На одной клетке возможна адсорбция до 300 частиц вирусов.
После прикрепления происходит расщепление стенки клетки ферментами лизоцима. Одновременно высвобождаются ионы кальция, активизирующие АТФазу – это вызывает сокращение чехла и введение стержня хвоста в клетку. Затем ДНК вируса впрыскивается в цитоплазму. Проникнув в бактерию, ДНК фага берёт на себя управление генетическим аппаратом клетки, осуществляя репродуктивный цикл фага.
В первую очередь происходит синтез ферментов, нужных для образования копий ДНК фага (ДНК-полимеразы, тимидилат синтетазы, киназы). Это занимает 5-7 минут с момента заражения. РНК-полимераза клетки преобразовывает вирусную ДНК в митохондриальную РНК, которая транслируется рибосомами в «ранние» белки. «Ранние» белки – это в основном вирусная РНК-полимераза и протеины, ограничивающие экспрессию генов бактерии. Вирусная РНК-полимераза производит транскрипцию, так называемых «поздних» белков, необходимых для сборки новых фаговых частиц.
Воспроизведение нуклеиновых кислот происходит за счёт активности, синтезированных ДНК-полимераз вируса. К окончанию цикла составляющие фага объединяются в зрелый вирион.
Эвакуация популяций Бактериофага из клетки
Вновь биосинтезированные белки в цитоплазме формируют пул предшественников. Другой пул включает ДНК потомства. Специализированные области в ДНК вируса индуцируют объединение этих белков около групп молекул нуклеиновой кислоты и синтез новых головок. Головка взаимодействует с хвостом, образуя дочерний фаг. После выхода потомства клетка хозяина разрушается, высвобождая новую популяцию.
Альтернативой разрушению клетки может выть интегративная форма взаимодействия при которой ДНК фага вместо репликации встраивается в хромосому бактерии или становится плазмидой. В результате, геном вируса реплицируется вместе с ДНК хозяина.
Виды Бактериофагов
Применение бактериофагов обуславливает их клиническую классификацию. Исходя из данного тезиса, можно выделить следующие виды бактериофагов:
- бактериофаги для терапии кишечных инфекций: дизентерийный, поливалентный, сальмонеллезный АВСДЕ-групп, брюшнотифозный, колипротейный, интести-бактериофаг (смесь фагов против наиболее частых возбудителей инфекций кишечника);
- бактериофаги для терапии гнойно-септических поражений: клебсиелловый пневмонии, клебсиелловый поливалентный, синегнойный, антистафилококковый бактериофаг, коли, протейный, стрептококковый, комбинированный пиобактериофаг (смесь фагов, уничтожающих большинство вероятных возбудителей инфекций гнойно-септического характера).
Применение в медицине препаратов бактериофага получает все большее распространение из-за участившихся случаев поливалентной резистентности возбудителей к антибактериальным средствам.