Лимфолейкоз
Содержание:
- Разновидности патологии
- Диагностика острого лимфобластного лейкоза
- Тесты
- Профилактика Острого лимфобластарного лейкоза:
- Причины развития заболевания у взрослых и детей
- Лейкоз может повлиять на эритроциты, лейкоциты и тромбоциты
- Другие заболевания из группы Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм:
- Общая информации
- Рецидивирующий или рефрактерный ОЛЛ
- Острый лимфобластный лейкоз у взрослых
- Острый лимфолейкоз: симптомы и диагностика
- Что провоцирует / Причины Острого лимфобластного лейкоза:
Разновидности патологии
Различают хронический и острый лейкоз. Первый не переходит во второй. Острая форма редко совмещается с хронической. Для нее характерна трансплантация незрелых клеток, их стремительное размножение и рост. При этом процесс не поддается контролю, поэтому высока вероятность смертельного исхода.
Хроническое течение характеризуется ростом видоизмененных готовых клеток или тех, которые находятся в стадии созревания. Длительность этой фазы значительно больше, чем острой формы. При хроническом течении недуга пациенту хватает поддерживающей терапии для восстановления здоровья.
Острая форма заболевания возникает в 75-85 случаях из 100. Врождённый рак может наблюдаться при мутации гена, сюда входят и болезни крови, синдром Дауна, генетическая наследственность. Удивительным фактом является то, что больше подвержены болезни те дети, которые выше и крупнее своих сверстников.
Острый лимфобластный лейкоз может быть как врожденным, так и приобретенным. Обычно если ребенок появляется на свет уже с этой патологией, то у него довольно низкий уровень выживаемости.
По характеру течения острый лейкоз делится на Т-клеточный и В-линейный. Это зависит от клеток, которые были предшественниками новообразования.
Лейкоциты, в свою очередь, классифицируются на гранулоцитарные и агранулоцитарные, зернистые и незернистые. Они подразделяются на эозинофилы, нейтрофилы, базофилы, лимфоциты, моноциты.
Основными рекомендациями врачей являются правильный состав питания, ведение активного образа жизни, отказ от вредных привычек, своевременное лечение всех возникающих патологий, особенно тех, которые способствуют развитию рака.
Диагностика острого лимфобластного лейкоза
Исследования, которые назначаются при подозрении на острый лимфолейкоз
| Название исследования | Описание | Как проводится? |
| Общий анализ крови | Общий анализ крови – самый быстрый и доступный способ, который позволяет заподозрить заболевание и направить больного на дальнейшее обследование. У 10% больных с острым лимфолейкозом картина крови нормальна – у них часто не удается заподозрить заболевание сразу. У 90% больных выявляются патологические изменения:
|
Кровь из пальца берут обычным способом, делая прокол при помощи специального скарификатора. |
| Определение уровня фермента лактатдегидрогеназы (ЛДГ) в крови. | Чем выше содержание ЛДГ, тем более тяжело протекает заболевание. | Кровь для исследования собирают в пробирку из вены. |
| Пункция красного костного мозга | При остром лимфолейкозе основные патологические изменения происходят в красном костном мозге. Поэтому изучение его образца помогает получить много ценной информации.Исследования красного костного мозга:
|
Пункцию красного костного мозга можно делать в разных местах:
Пункцию костного мозга осуществляют при помощи специальной иглы и шприца. Погружая иглу в кость и потягивая поршень шприца, врач получает необходимое количество красного костного мозга. Процедура достаточно болезненна. Её выполняют под местной анестезией или под общим наркозом. |
| Обследование внутренних органов | Проводят УЗИ, компьютерную, магнитно-резонансную томографию для того, чтобы оценить состояние селезенки и других внутренних органов, выявить их увеличение. | Исследования проводятся по назначению врача. |
| Рентгенография, компьютерная томография, магнитно-резонансная томография грудной клетки | У многих больных выявляется увеличение тимуса и внутригрудных лимфатических узлов. | |
| Люмбальная пункция | Во время люмбальной пункции врач получает небольшое количество спинномозговой жидкости. У некоторых больных (в среднем у 3-5 из 100) в ней обнаруживаются лейкемические клетки. Это свидетельствует о поражении нервной системы. | Врач укладывает пациента на кушетку на бок. В области поясницы обрабатывают кожу раствором антисептика и проводят местную анестезию. Вводят между позвонками специальную иглу и получают необходимое количество спинномозговой жидкости, которую отправляют в лабораторию для анализа. |
Тесты
Могут быть использованы следующие тесты и процедуры:
Осмотр и история: осмотр тела, чтобы проверить общие признаки здоровья, в том числе проверка на наличие признаков болезни, таких как инфекции или что-нибудь еще, что кажется необычным
Также будут приняты во внимание история болезни, привычки пациента и перенесенные заболевания и варианты их лечения. Это только начало, поскольку врачу нужно в ходе осмотра нужно убедиться в необходимости последующих действий
Хотите сказать, что из-за спорных симптомов, извините, “тащиться” в поликлинику с неизвестным результатом? Ну а как вы хотите? Все равно этот этап нужно пройти, чтобы либо убрать тревогу по поводу состояния, либо напрячься и начать проходить следующие тестовые процедуры. Нельзя оставлять на самотек! У кого нет особого времени, есть возможность вызвать врача на дом. Вот специально нашел (интересовался ценами) такую услугу в С.Петербурге (повезло им) – вызов врача на дом в Фрунзенский район, хотя на самом деле врачи из этого центра ездят по заказу в любой район города и даже за город.
Из этого центра можно вызвать даже онколога. Стоимость вызова 3 – 4 тысячи. Учитывая плотность движения по городу, цена совсем даже демократичная. Учитывая, что ОЛЛ развивается в ускоренном режиме, кажется, можно позвать и выслушать “постановление”.
Вполне возможно и в других городах тоже есть подобная услуга. Интересуйтесь! Не будьте инертными к своим проблемам. Сами они не рассосутся!
Общий анализ крови (CBC) с дифференциацией: процедура, при которой образец крови обращается и проверяется на следующее:
- Количество эритроцитов и тромбоцитов.
- Количество и тип белых кровяных клеток.
- Количество гемоглобина (белок, который переносит кислород) в эритроцитах.
- Часть образца крови из эритроцитов.
В принципе вам не следует заморачиваться деталями. Врач назначит, сдадите кровь в общем порядке и все – получите данные. Кому интересно. Читайте в Инете.
Биохимический анализ крови: процедура для проверки образца крови, которая применяется для измерения количества определенных веществ, выделяемых в кровь по органам и тканям организма. Необычный (выше или ниже нормы) уровень количества вещества может быть признаком болезни в органе или ткани.
Мазок периферической крови: процедура для проверки образца крови, производимая на доменных клетках на предмет количества и видов белых кровяных клеток, количества тромбоцитов, а также изменений в форме клеток крови. Для понимания, что такое доменные клетки обратитесь к Википедии с запросом “Эукариоты”. Кому надо – разберетесь. Всем остальным эта информация лишняя.Пункция и биопсия костного мозга: забор образца костного мозга, крови и маленького кусочка кости, вставив полую иглу в тазовую кость. Затем патологоанатом рассматривает образец костного мозга, крови и кости под микроскопом в поисках аномальных клеток.
Пункция и биопсия костного мозга. После того, как небольшой участок кожи онемеет, игла Jamshidi (длинный, полая игла) вставляется в кость бедра пациента. Делается забор образцов крови, костей и костного мозга для исследования под микроскопом.
Следующие тесты могут быть сделаны на образцах крови или тканей костного мозга, которые берутся на анализ:
Цитогенетический анализ: лабораторный тест, в котором клетки в образце крови или костного мозга исследуют под микроскопом, чтобы выяснить, есть ли определенные изменения в хромосомах в лимфоцитах. Например, иногда в целом, часть одной хромосомы переносится в другую хромосому. Это называется Филадельфийской хромосомой. Другие тесты, такие как флуоресцентная гибридизация (или метод FISH), также может быть сделана, чтобы выявить определенные изменения в хромосомах.
Иммунофенотипирование: процесс, используемый для идентификации клеток, на основе типов антигенов или маркеров на поверхности клетки. Этот процесс используется для диагностики подтипа лимфобластного лейкоза путем сравнения раковых клеток в нормальных клетках иммунной системы. Например, исследование, проведенное методом цитохимии, может проверить клетки в образце ткани с использованием химических веществ (красителей), чтобы выявить определенные изменения в выборке. Химическим путем может вызвать изменение цвета в одном типе клеток лейкемии, но не в другом типе клеток лейкемии.
Профилактика Острого лимфобластарного лейкоза:
Профилактика
Дозу 24 Гр на голову дают на 3 недели по 1,5 Гр за сеанс с двух латеральных полей.
Одну из двух инъекций метотрексата, вводимого 2 раза в неделю в спинномозговой канал, во время облучения головы целесообразно производить в субботу, так как в этот день, как правило, не бывает лучевой терапии, другую — в один из первых дней недели
после сеанса облучения головы; в день эндолюмбального введения метотрексата больной остается в стационаре.
В период профилактики нейролейкемии с помощью как облучения, так и введения метотрексата и цитозара, больные получают внутрь 6-меркаптопурин ежедневно в дозе 25 мг/м2 и циклофосфамид в дозе 100 мг/м2 1 раз в неделю.
После окончания профилактики нейролейкемии делают пункцию костного мозга, и если признаков рецидива нет, то начинают поддерживающую терапию.
Вторым методом профилактики нейролейкемии является эндолюмбальное введение метотрексата и цитозара. Препараты вводят с интервалом 3-4 дня, при плохой переносимости 1 раз в неделю.
Оба метода профилактики нейролейкемии надежны и позволяют отказаться от поддерживающих интралюмбальных введений метотрексата.
Непрерывное поддерживающее лечение в период улучшения острых лимфобластного и недифференцируемого лейкозов детей проводится амбулаторно, в течение 5 лет до полного улучшения. Начинают лечение сразу после достижения полного улучшения или после курсов, закрепляющих достигнутое улучшение.
Дети получают непрерывное лечение тремя препаратами по следующей схеме: 6-меркаптопурин внутрь ежедневно; метотрексат внутрь на 6-й день недели; циклофосфамид внутрь на 7-й день недели, в эти дни 6-меркаптопурин не отменяют.
Для «группы риска» в период непрерывного поддерживающего лечения тремя препаратами каждые 1,5-2 месяца проводится курс СО АР. Во время данного курса в течение недели после него поддерживающее лечение тремя препаратами отменяется, а затем в течение недели проводится половинными дозами. После этого поддерживающее лечение проводится полными дозами.
Условия проведения непрерывного лечения:
1) анализ крови с определением тромбоцитов и ретикулоцитов 1 раз в неделю;
2) при снижении уровня лейкоцитов до 1 Ч 103 — 2 Ч 103 (1000-2000) в 1 мкл врач снижает дозу цитостатических препаратов вдвое, при последующем его повышении более 2,5 Ч 103 (2500) в 1 мкл восстанавливают прежнюю дозу;
3) лечение прерывают на любом этапе при падении уровня лейкоцитов в крови ниже 1000 в 1 мкл, при значительном повышении температуры, стоматите, диарее;
4) пункцию костного мозга в первый год улучшения производят 1 раз в месяц; на 2-5-м году улучшения — 1 раз в 3 месяца.
Лечение острого лимфобластного лейкоза усиливается, когда речь идет о процессе Т-клеточной природы. По программе американских педиатров-онкологов для устранения проявлений болезни при Т-лимфобластном остром лейкозе начинают с внутривенного введения циклофосфана по 1200 мг/м2 в 1-й день лечения или между 2-м и 5-м днем (при уровне лейкоцитов более 5 Ч 104 (50 000) в 1 мкл и значительной органомегалии, требующих предварительного назначения аллопуринола из-за высокого уровня мочевой кислоты в сыворотке и опасности развития мочекислого диатеза). С 3-4-го дня (или в 1-й день, если введение циклофосфана отсрочено) еженедельно (1 раз в неделю) по этой программе, как и по программе Aur, вводится винкристин в течение 4 недели, а также
применяют преднизолон и рубомицин в дозах и в сроки, соответствующие схеме 2 лечения острого лимфобластного лейкоза.
При достижении ремиссии проводится курс ее консолидации, включающий 5-дневное непрерывное введение цитозара по 100 мг/(м2/сут.), прием тиогуанина (или 6-меркаптопурина) по 50 мг/м2 каждые 12 ч в течение 5 дней введения цитозара. Проводят 3 курса лечения цитозаром и тиогуанином (6-меркаптопурин) с интервалом между курсами 14 дней.
Затем в течение 7-14 дней внутривенно капельно вводят L-acnapaгиназу по 200-300 ЕД/кг. В случае высокого уровня лейкоцитов и большой массы опухолевых лимфатических узлов спленомегалии или гепатомегалии терапию нужно проводить, назначая больному большое количество жидкости, щелочное питье, наряду с аллопуринолом для профилактики мочекислого диатеза.
Если при Т-клеточном остром лейкозе в средостении определяются увеличенные лимфатические узлы, плохо сокращающиеся от химиотерапии, то рекомендуется локальное облучение этой области в дозе 30 Гр; локальное облучение целесообразно и при значительном увеличении лимфатических узлов любой другой области.
Лечение в период улучшения при Т-клеточном лейкозе должно быть усилено: наряду с непрерывной терапией 6-меркаптопурином, метотрексатом, циклофосфаном.
Причины развития заболевания у взрослых и детей
Острый лимфобластный лейкоз (ОЛЛ) этиологий развития:
- генетическая предрасположенность/наследственность;
- радиационное облучение;
- контактирование с вредными химическими веществами и канцерогенами;
- поражение вирусными агентами.
 Генетическая предрасположенность – возможная причина лимфобластного лейкоза
Генетическая предрасположенность – возможная причина лимфобластного лейкоза
Основной причиной возникновения данной патологии считается генетическая предрасположенность. Это связано с механизмом происхождения патологии. Непосредственной причиной ОЛЛ является образование злокачественного клона – клетки, которые которые обладают способностью бесконтрольно размножаться. Сам клон возникает вследствие хромосомных нарушений:
- перемена двух участков хромосом – транслокация;
- потеря участка хромосомы – делеция;
- перевернутый участок хромосомы – инверсия;
- копирование участков хромосомы – амплификация.
Предположительно, что все эти изменения происходят еще во внутриутробном развитии, однако необходимы и внешние факторы, под воздействием которых происходит завершение процесса.
Наибольшим воздействием обладает такой внешний фактор, как радиационное облучение. К ним относится проживание в регионе с повышенным радиационным излучением, лечение онкопатологий при помощи радиотерапии, многократное рентгеновское обследование, в том числе в период вынашивания ребенка. Доказанность между данными факторами и заболеваниями, а также их зависимость сильно отличаются друг от друга.
Точно доказана связь между лучевой терапией и лейкозом. Риск возникновения ОЛЛ в данном случае достигает 10%. При этом у 80-85% пациентов, проходивших данный метод лечения диагностируется лейкоз в течение 10 лет после завершения терапии. В случае с рентгеновскими исследованиями данная связь не является доказанной и остается только на уровне предположений.
Также есть предположение в связи между инфекционными заболеваниями и ОЛЛ. Вируса, который вызывает лимфобластный лейкоз не существует, однако в этом плане выдвинуты две основные теории. По первой считается, что вирус, который вызывает ОЛЛ существует, просто в настоящее время он не выявлен, а заболевание получает развитие только при определенной предрасположенности. Согласно второй теории заболевание может возникнуть при контакте с определенными вирусными патологиями, когда иммунитет ребенка является нетренированным, то есть имеет малое количество контактов с различными вирусами. Обе теории не доказаны. Только для некоторых стран Азии имеются подтверждения в данных догадках.
Вероятность появления заболевания резко повышается при контактировании матери с различными вредными веществами. Однако она существует только при врожденных генетических отклонениях, наличии в семейном анамнезе онкологических заболеваний, при приеме цитостатиков. Некоторые специалисты считают, что негативное влияние оказывает и курение матери в период гестации.
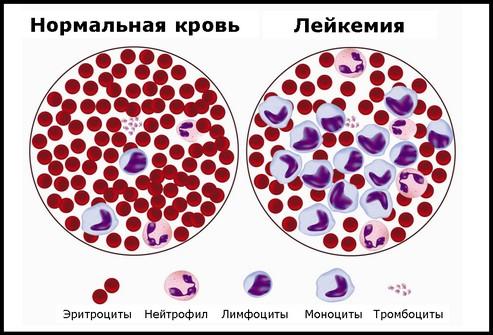
Лейкоз может повлиять на эритроциты, лейкоциты и тромбоциты
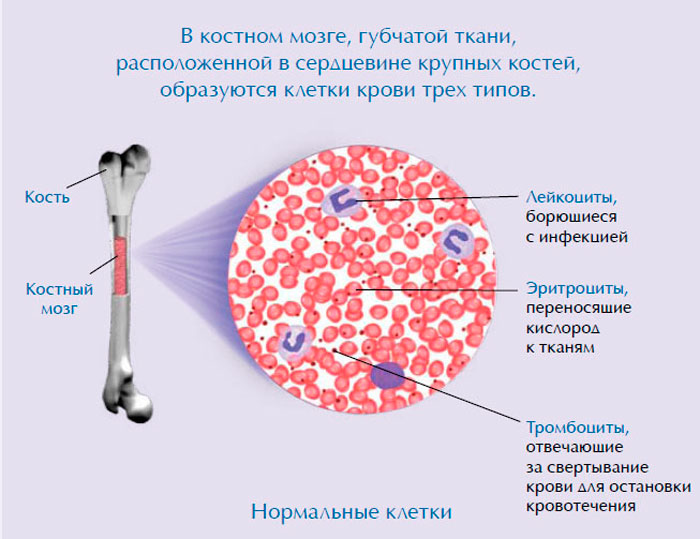
Миелоидная стволовая клетка становится одним из трех типов зрелых клеток крови:
- Эритроциты, несущие кислород и другие вещества, во все ткани организма.
- Тромбоциты, которые нужны для образования сгустков крови, за счет которых останавливается кровотечение.
- Гранулоциты (белые кровяные клетки), задачей которых является борьба с инфекциями и болезнями.
Лимфоидная стволовая клетка становится лимфобластной клеткой, а затем одним из трех типов лимфоцитов (белых кровяных телец):
- В-лимфоциты, которые производят антитела, в задачу которых входит оказание помощи в борьбе с инфекциями.
- Т-лимфоциты, которым “выпала честь” помогать В-лимфоцитам в производстве антител, которые помогают бороться с инфекцией.
- Природные киллеры, которые должны эффективно атаковать раковые клетки и вирусы.
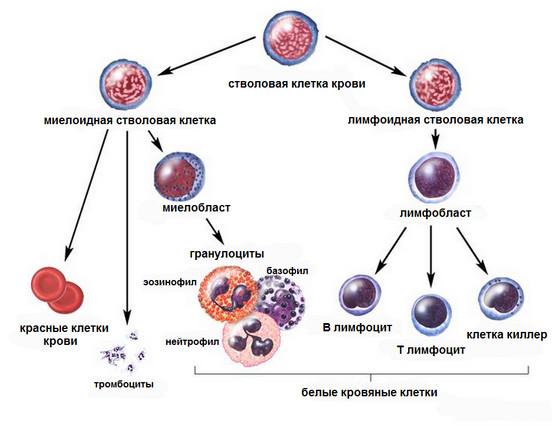
В общем случае лимфобластного лейкоза, слишком много стволовых клеток становятся лимфобластами, а затем В-лимфоцитами, или Т-лимфоцитами. Эти клетки также называют лейкозные клетки. Эти клетки лейкемии не в состоянии эффективно бороться с инфекцией. Кроме того, так как количество лейкозных клеток возрастает в крови и костном мозге, существует меньше возможностей для здоровых белых кровяных клеток, красных кровяных клеток и тромбоцитов. Это может привести к инфекции, анемии, а также легким кровотечениям. Рак может также распространиться на центральную нервную систему (головной и спинной мозг)
Важно! Предыдущая химиотерапия и облучение могут увеличить риск развития ОЛЛ. Все, что увеличивает риск заболевания называется фактором риска
Имея факторы риска не означает, что у вас разовьется рак; отсутствие факторов риска не означает, что вы не получите рак. Стоит поговорить с врачом, если у вас есть предположение, что вы можете быть в опасности. В подобных случаях стеснение по поводу обращения к врачу может сыграть для вас отрицательную роль. Врачу от этого никаких последствий. Запомните это, поскольку “спасение утопающего дело рук самого утопающего”. Стучитесь в двери поликлиники, как только почувствуете недомогание.
Вот возможные факторы риска для всех:
- Вы мужчина.
- Вам больше 70-ти лет.
- Вы прошли лечение химиотерапией или лучевой терапией.
- Вы подверглись радиоактивному облучению.
- У вас есть определенные генетические расстройства, такие как, например, синдром Дауна.
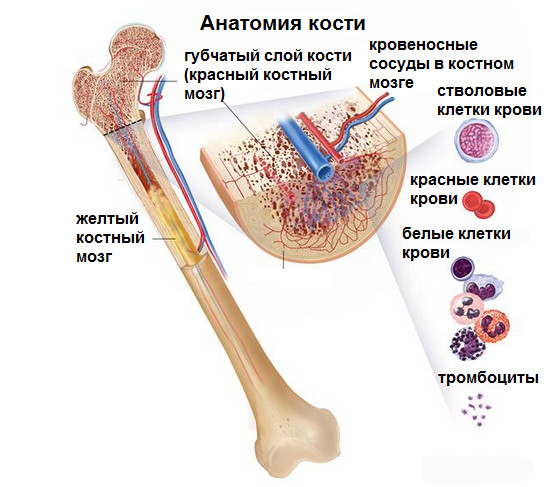
Анатомия костей. Кость состоит из компактной кости, губчатой кости и костного мозга. Компактная кость составляет наружный слой кости. Губчатая кость находится в основном на концах костей и содержит красный костный мозг. Костный мозг находится в центре большинства костей и имеет много кровеносных сосудов. Есть два типа костного мозга: красный и желтый. Красный костный мозг содержит стволовые клетки крови, которые могут стать красными кровяными клетками, белые кровяные клетки, или тромбоциты. Желтый костный мозг состоит, в основном, из жиров.
Другие заболевания из группы Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм:
| B12-дефицитная анемия |
| Анемии, обусловленные нарушением синтеза утилизацией порфиринов |
| Анемии, обусловленные нарушением структуры цепей глобина |
| Анемии, характеризующиеся носительством патологически нестабильных гемоглобинов |
| Анемия Фанкони |
| Анемия, связанная со свинцовым отравлением |
| Апластическая анемия |
| Аутоиммунная гемолитическая анемия |
| Аутоиммунная гемолитическая анемия |
| Аутоиммунная гемолитическая анемия с неполными тепловыми агглютининами |
| Аутоиммунная гемолитическая анемия с полными Холодовыми агглютининами |
| Аутоиммунная гемолитическая анемия с тепловыми гемолизинами |
| Болезни тяжелых цепей |
| болезнь Верльгофа |
| Болезнь Виллебранда |
| болезнь Ди Гулъелъмо |
| болезнь Кристмаса |
| Болезнь Маркиафавы-Микели |
| Болезнь Рандю — Ослера |
| Болезнь тяжелых альфа-цепей |
| Болезнь тяжелых гамма-цепей |
| Болезнь Шенлейн — Геноха |
| Внекостномозговые поражения |
| Волосатоклеточный лейкоз |
| Гемобластозы |
| Гемолитико-уремический синдром |
| Гемолитико-уремический синдром |
| Гемолитическая анемия, связанная с дефицитом витамина Е |
| Гемолитическая анемия, связанная с дефицитом глюкозо-6-фосфатдегидрогеназы (Г-6-ФДГ) |
| Гемолитическая болезнь плода и новорожденного |
| Гемолитические анемии, связанные с механическим повреждением эритроцитов |
| Геморрагическая болезнь новорожденных |
| Гистиоцитоз злокачественный |
| Гистологическая классификация лимфогранулематоза |
| ДВС-синдром |
| Дефицит К-витаминзависимых факторов |
| Дефицит фактора I |
| Дефицит фактора II |
| Дефицит фактора V |
| Дефицит фактора VII |
| Дефицит фактора XI |
| Дефицит фактора XII |
| Дефицит фактора XIII |
| Железодефицитная анемия |
| Закономерности опухолевой прогрессии |
| Иммунные гемолитические анемии |
| Клоповое происхождение гемобластозов |
| Лейкопении и агранулоцитозы |
| Лимфосаркомы |
| Лимфоцитома кожи (болезнь Цезари) |
| Лимфоцитома лимфатического узла |
| Лимфоцитома селезенки |
| Лучевая болезнь |
| Маршевая гемоглобинурия |
| Мастоцитоз (тучноклеточный лейкоз) |
| Мегакариобластный лейкоз |
| Механизм угнетения нормального кроветворения при гемобластозах |
| Механическая желтуха |
| Миелоидная саркома (хлорома, гранулоцитарная саркома) |
| Миеломная болезнь |
| Миелофиброз |
| Нарушения коагуляционного гемостаза |
| Наследственная a-fi-липопротеинемия |
| Наследственная копропорфирия |
| Наследственная мегалобластная анемия при синдроме Леш — Найана |
| Наследственные гемолитические анемии, обусловленные нарушением активности ферментов эритроцитов |
| Наследственный дефицит активности лецитин-холестерин-ацилтрансферазы |
| Наследственный дефицит фактора X |
| Наследственный микросфероцитоз |
| Наследственный пиропойкилоцитоз |
| Наследственный стоматоцитоз |
| Наследственный сфероцитоз (болезнь Минковского-Шоффара) |
| Наследственный эллиптоцитоз |
| Наследственный эллиптоцитоз |
| Острая перемежающаяся порфирия |
| Острая постгеморрагическая анемия |
| Острые лимфобластные лейкозы |
| Острый лимфобластный лейкоз |
| Острый лимфобластный лейкоз |
| Острый малопроцентный лейкоз |
| Острый мегакариобластный лейкоз |
| Острый монобластный лейкоз |
| Острый промиелоцитарный лейкоз |
| Острый промиелоцитарный лейкоз |
| Острый эритромиелоз (эритролейкоз, болезнь Ди Гульельмо) |
| Отдельные формы лейкозов |
| Пароксизмалъная холодовая гемоглобинурия |
| Пароксизмальная ночная гемоглобинурия (болезнь Маркьяфавы-Микели) |
| Парциальная красноклеточная аплазия |
| Патологическая анатомия поражения оболочек |
| Плазмоклеточный острый лейкоз |
| Полиорганная недостаточность |
| Поражение нервной системы |
| Порфирии |
| Принципы разделения злокачественных и доброкачественных опухолей системы крови |
| Приобретенные геморрагические коагулопатии |
| Причины гемобластозов |
| Пролимфоцитарный лейкоз |
| Ретикулез (ретикулогистиоцитоз, нелипидный ретикулоэндотелиоз, болезнь Абта-Леттерера-Сиве) |
| Серповидно-клеточная анемия |
| Серповидно-клеточная анемия |
| Синдром Дайемонда — Блекфана |
| Сублейкемический миелоз |
| Т-клеточный лейкоз-лимфома взрослых |
| Талассемия |
| Талассемия |
| Тромбофилий, связанные с дефицитом антитромбина III |
| Тромбоцитопатии |
| Тромбоцитопении |
| Фолиеводефицитная анемия |
| Хроническая лучевая болезнь |
| Хронический лимфолейкоз |
| Хронический лимфолейкоз (хронический лимфоидный лейкоз) |
| Хронический лимфоцитарный лейкоз |
| Хронический мегакариоцитарный лейкоз |
| Хронический миелоидный лейкоз |
| Хронический миелолейкоз |
| Хронический моноцитарный лейкоз |
| Хронический моноцитарный лейкоз |
| Хронический эритромиелоз |
| Цитостатическая болезнь |
| Энтеропатии и кишечный дисбактериоз |
| Эритремия |
| Эритремия (истинная полицитемия, эритроцитоз, болезнь Вакеза) |
| Эритропоэтическая копропорфирия |
| Эритропоэтическая протопорфирия |
| Эритропоэтические уропорфирии |
| Ювенильный миеломоноцитарный лейкоз |
Общая информации
Острый лимфобластный лейкоз (ОЛЛ) является наиболее частым онкологическим заболеванием у детей, но поражает также и взрослых всех возрастов. Злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированных, долго живущих гемопоэтических клеток-предшественниц приводит к появлению большого количества циркулирующих бластных клеток, замещению нормального костного мозга опухолевыми клетками и возможности лейкемической инфильтрации ЦНС и яичках.
Симптомы включают утомляемость, бледность, инфекции, боли в костях, симптомы расстройства ЦНС (например, головная боль), склонность к подкожным кровоизлияниям и кровотечениям. Диагноз в большинстве случаев можно поставить на основании изучения мазка периферической крови и костного мозга.
Лечение обычно включает комбинированную химиотерапию до достижения ремиссии, интратекальную и системную химиотерапию и/или кортикостероиды для профилактики расстройств ЦНС, иногда черепно-мозговое облучение, направленное на интрацеребральной лейкозный инфильтрат, консолидирующую химиотерапию с трансплантацией стволовых клеток или без нее и поддерживающую химиотерапию в течение до 3 лет во избежание рецидива.
Рецидивирующий или рефрактерный ОЛЛ
Лейкозные клетки могут повторно появиться в костном мозге, ЦНС, яичках и в других органах. Наиболее опасен костномозговой рецидив. Хотя новый курс химиотерапии приводит к второй ремиссии у большинства детей и около трети взрослых, последующие ремиссии, как правило, недолгие. При химиотерапии лишь небольшая часть больных с ранним костномозговым рецидивом достигает длительной безрецидивной вторичной ремиссии или излечения.
Новые подходы к иммунотерапии показывают впечатляющие результаты при рецидивирующем/рефрактерном ОЛЛ. Антитела, такие как блинатумомаб, которые приносят Т клетки к лейкозным бластам, показывают эффективность при рецидивирующем ОЛЛ. Химерный антигенный рецептор Т-клеток (CAR-T), созданный и полученный от Т-клеток пациента, успешно вызывает ремиссию у пациента с рецидивом ОЛЛ, хотя и обладает существенной токсичностью (2).
Доступные сеансы иммунотерапии для рецидивирующего или рефрактерного ОЛЛ включают
- Блинатумомаб
- Инотузумаб озогамицин
- Тисагенлеклейсел
Блинатумомаб, биоспецифический CD19-направленный активатор CD3 T-клеток, продлевает общую выживаемость у детей и взрослых с рецидивирующим или рефрактерным пре-B-клеточным ОЛЛ, будь то Ph+ или Ph-. Опасные для жизни токсические эффекты могут включать синдром высвобождения цитокинов и симптомы токсического поражения нервной системы (например, судороги, энцефалопатию с нарушением сознания и нарушением речи, координации и/или равновесия). Может потребоваться прерывание или прекращение использования блинатумомаба с применением высокой дозы дексаметазона или без него. Наиболее распространенными неврологическими симптомами после применения блинатумомаба являются головная боль и тремор (3).
Инотузумаб озогамицин, CD22-направленное, нагруженное лекарством антитело с калихеамицином, также доступен для применения у взрослых с рецидивирующим или рефрактерным про-B-клеточным ОЛЛ. Одно из исследований показало, что частота ремиссии значительно выше после 1–2 циклов терапии инотузумаба озогамицином в сравнении со стандартной химиотерапией (4). Инотузумаб может вызывать гепатотоксичность, в том числе смертельные и угрожающие жизни веноокклюзионные заболевания, и его применение связано с более высокой смертностью после трансплантации, не зависящей от рецидива заболевания.
Тисагенлеклейсел, препарат CD19-направленной генетически модифицированной аутологичной Т-клеточной иммунотерапии, доступен для лечения пациентов в возрасте до 25 лет с ОЛЛ из В-клеточных предшественников в невосприимчивой форме, либо со вторым или с последующим рецидивами. Может возникнуть синдром высвобождения цитокинов, а также представляющая опасность для жизни или со смертельным исходом неврологическая токсичность (5).
Другие лекарства, которые на данный момент доступны, но для которых при этом клинически значимые результаты не были убедительно показаны, включают:
- Липосомный винкристин (алкалоид барвинка): для взрослых с Ph-негативным ОЛЛ, по крайней мере, во время 2-го рецидива или прогрессирования, несмотря на ≥ 2 курса противолейкозной терапии
- Клофарабин (аналог пуринового нуклеозида): для пациентов в возрасте от 1 до 21 года с рецидивирующим или рефрактерным ОЛЛ после ≥ 2 предыдущих схем
- Аналог пролекарственного препарата с использованием арабинозида гуанозида препарат неларабин (пуриновый нуклеозид): для Т-клеток ОЛЛ, которые не дают ответа, или рецидив которых произошел после ≥ 2 предыдущих схем лечения.
Трансплантация стволовых клеток при наличии HLA-идентичных сиблингов после индукционной химиотерапии или иммунотерапии дает самую большую вероятность достижения долгосрочной ремиссии или излечения. Иногда используются клетки от других родственных доноров или от совместимых с реципиентом доноров, несовместимых с реципиентом доноров. Трансплантация редко используется для пациентов > 65 лет, потому что вероятность успешного исхода очень мала, а побочные эффекты, скорее всего, будут смертельными.
При рецидивах с поражением ЦНС применяется интратекальное введение метотрексата (с или без цитарабина или кортикостероидов) дважды в неделю до исчезновения всех симптомов. Роль продолжительного применения интратекальных препаратов и облучения ЦНС остается неясной.
Рецидив в яичках может клинически проявляться безболезненным плотным увеличением тестикул или может быть выявлен при биопсии. При клинических признаках одностороннего поражения необходимо проведение биопсии непораженного яичка. Лечение включает лучевую терапию пораженного яичка и системную реиндукцию.
Острый лимфобластный лейкоз у взрослых
Относительно недавно он считался «детским» заболеванием ввиду подверженности ему преимущественно маленьких пациентов в возрасте двух-четырех лет. В настоящее время наблюдается и среди взрослых.
Точные причины заболевания ученым до сих пор неизвестны.
Но существуют определенные факторы риска, в числе которых:
- возраст;
- половая принадлежность (у мужчин заболевание встречается чаще, чем у женщин);
- принадлежность к белой расе, (темнокожие меньше подвержены этому заболеванию);
- пройденное ранее лечение онкологических заболеваний и облучение;
- наличие генетических нарушений (Синдром Дауна).
Острый лимфолейкоз: симптомы и диагностика
Острый лимфолейкоз (острая лимфобластная лейкемия) – злокачественное заболевание, как правило, проявляющееся у детей в возрасте 2-4 лет.
Симптомами лимфолейкоза острого являются общая слабость и недомогание. Аппетит у больных резко падает, температура тела немотивированно поднимается, кожа приобретает бледный цвет из-за анемии и общей интоксикации организма.
Также симптомами лимфолейкоза острого являются болевые ощущения в конечностях и позвоночнике. Развитие лимфолейкоза у детей характеризуется увеличением периферических, а иногда и медиастинальных лимфоузлов. Примерно в половине случаев наблюдается развитие геморрагического синдрома, для которого характерны кровоизлияния и петехии.
Нередко может развиться нейролейкемия вследствие возникновения экстрамедуллярных очагов поражения ЦНС.
Для правильной постановки диагноза лимфолейкоза у детей необходимо провести МРТ, ЭЭГ, томографию головного мозга, а также исследование ликвора. Обследование больных начинается с проведения анализов периферической крови. В случае острого лимфолейкоза обычно выявляется тромбоцитопения и нормохромная анемия. Таким образом, заподозрить наличие болезни опытный врач может уже на основании общей картины крови и жалоб пациента. Однако точный диагноз возможно поставить только после детального исследования красного костного мозга.
Что провоцирует / Причины Острого лимфобластного лейкоза:
В генетической основе развития острого лимфобластного лейкоза лежат изменения в структуре хромосом, т.е. хромосомные аберрации. При лейкозах выделяют специфические или первичные и неспецифические хромомомнве аберрации. К первичным принято относить транслокации, делеции, инверсии, амплификации участков хромосом, содержащих онкогены, гены клеточных рецепторов, гены ростовых факторов. Подобные изменения способны образовывать новые последовательности ДНК и появление новых свойств у клетки, образование специфического клона. Вторичные хромосомные аберрации появляются на стадии опухолевой прогрессии в результате изменений сформировавшегося клона. Причем схожие аберрации могут наблюдаться при различных вариантах лейкозов. Так, филадельфийская хромосома может выявляться как при острых, так и при хронических лейкозах.
Причины развития острого лимфобластного лейкоза у детей до сих пор точно не установлены, однако имеются данные о большом значении инфекционных заболеваний в младенческом возрасте, воздействию различных физических (например, рентгенодиагностика, лучевая терапия, ионизирующая радиация), действие химических мутагенов. при воздействию бензола, среди больных, получавших цитостатические иммунодепрессанты (имуран, циклофосфан, лейкаран, сарколизин, мустарген и др.), биологических (вирусных) мутагенов на организм матери во время беременности. Доказана также связь между многими врожденными хромосомными аномалиями и развитием острого лейкоза.