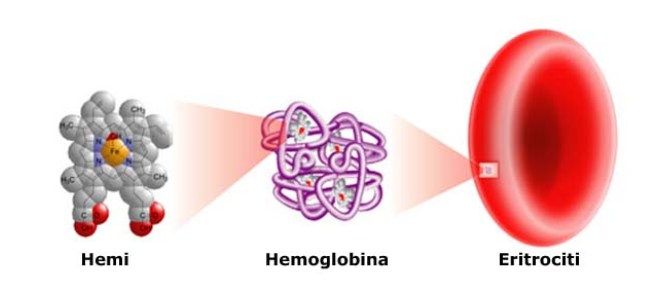
Кроветворение
Содержание:
- Типы кроветворных тканей
- Болезни группы гемобластозов
- Роль витамина В12 в кроветворении
- Что такое костный мозг
- Что влияет на кроветворение?
- Возрастные особенности красного костного мозга
- Регуляция гемопоэза
- Эмбриональное кроветворение.
- Тимус
- Селезенка (splen, lien)
- В Т- и в В-лимфоцитопоэзе выделяют три этапа:
- За что отвечает желтый костный мозг
Типы кроветворных тканей
Кроветворная ткань делится на 2 типа тканей:
Миелоидная ткань
Это тип кроветворной ткани, связанный с продукцией эритроцитов (эритропоэз), гранулированных лейкоцитов и мегакариоцитов. Фрагменты мегакариоцитов образуют тромбоциты (тромбоциты).
Миелоидная ткань расположена на уровне медуллярного канала и пространства трабекулярной кости длинных костей у молодых животных. У взрослых животных оно ограничено только на уровне эпифизов длинных костей.
На эмбриональной стадии эта ткань обнаруживается в печени и селезенке и может сохраняться даже в течение первых недель жизни. У людей миелоидная ткань обычно ограничивается костным мозгом ребер, грудины, позвонков и эпифизами длинных костей тела..
Лимфоидная ткань
Лимфоидная ткань также является кроветворной тканью. Эта ткань существует в очень хорошо определенных органах, которые имеют покрытие соединительной ткани. Он называется инкапсулированной лимфатической тканью, а органы, которые ее представляют, — это лимфатические узлы, селезенка и тимус.
Существует также неинкапсулированная лимфатическая ткань, которая образует защитный барьер в организме; в органах, подверженных загрязнению окружающей среды, таких как подслизистая оболочка кишечника, дыхательные пути, мочевыводящие пути и половые органы.
Болезни группы гемобластозов
В основном это онкологические заболевания крови, список самых распространенных включает в себя разновидности лейкозов. Последние, в свою очередь, делят на два типа – острые (большое количество раковых клеток, функции не выполняют) и хронические (протекает медленно, функции клеток крови выполняются).
Острый миелобластный лейкоз – нарушения в делении клеток костного мозга, их созревания. В зависимости от характера протекания болезни, выделяют следующие виды острого лейкоза:
- без созревания;
- с созреванием;
- промиелоцитарный;
- миеломонобластный;
- монобластный;
- эритробластный;
- мегакариобластный;
- лимфобластный Т-клеточный;
- лимфобластный В-клеточный;
- панмиелолейкоз.
Хронические формы лейкоза:
- миелолейкоз;
- эритромиелоз;
- моноцитарный лейкоз;
- мегакариоцитарный лейкоз.
Во внимание берутся вышеперечисленные заболевания хронической формы. Болезнь Леттерера-Сиве – прорастание клеток иммунной системы в разные органы, происхождение болезни неизвестно
Болезнь Леттерера-Сиве – прорастание клеток иммунной системы в разные органы, происхождение болезни неизвестно.
Миелодиспластический синдром – группа заболеваний, поражающих костный мозг, к которым относится, например, сублейкемический миелоз.
Роль витамина В12 в кроветворении
В кроветворении принимают участие различные витамины, среди которых особая роль принадлежит витамину В12, содержащему кобальт.
Источником витамина В12 служат продукты животного происхождения; в растительных продуктах он отсутствует. Благодаря этому витамину поддерживается нормальный процесс созревания эритроцитов у здорового человека.
В сутки взрослому человеку необходимо 3—5 мг витамина В12. Как показали современные исследования, витамин В12, попавший в организм с пищей, всасывается в кишечнике лишь при соединении его с особым белком — гастромукопротеином (который иначе называется «внутренний фактор»).
Гастромукопротеин вырабатывается у человека железами желудка и обладает способностью образовывать с витамином В12 комплексное соединение. Оказалось, что этот белок предохраняет витамин от пожирания микроорганизмами, заселяющими кишечник. Таким образом, он выступает в роли «проводника» витамина В12 и спасает его от разрушающего действия микробов.
Всосавшийся витамин накапливается в печени и затем используется для целей кроветворения по мере необходимости.
Установлено, что витамин B12 принимает активное участие в образовании соединений, являющихся составными частями нуклеиновых кислот, — тех самых кислот, коими так богаты ядра клеток и которые определяют основные наследственные признаки организма.
В случае нехватки витамина B12 задерживается синтез нуклеиновых кислот, в результате чего неизбежно нарушается деление постоянно размножающихся кроветворных клеток. Тогда в костном мозге вместо нормальных эритробластов появляются огромные, медленно созревающие клетки, получившие название мегалобластов (от греческого слова «мегалос» — огромный).
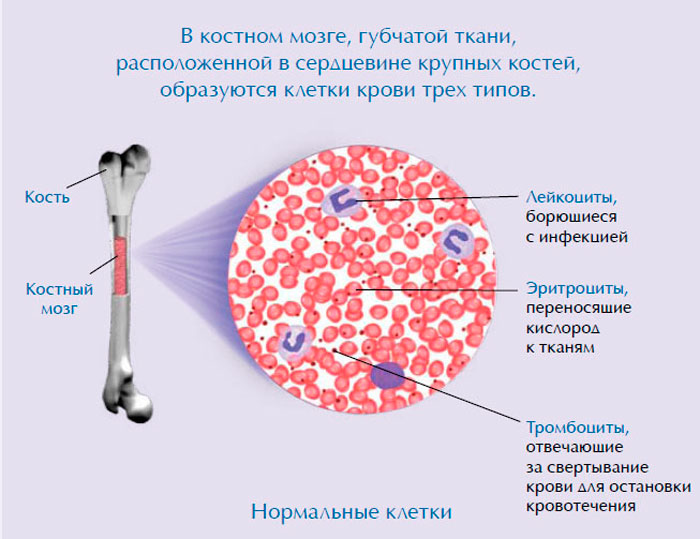
Что такое костный мозг
Костный мозг для кроветворной системы является важнейшим органом, ведь его главная функция – как раз осуществление гемопоэза, или кроветворения. Он непосредственно участвует в создании новых клеток крови взамен тех, что погибли, отмерли. Кроме того, единственной тканью взрослого человека, в которой содержатся незрелые клетки, известные также как стволовые, является именно костный мозг.
Костный мозг бывает двух типов: желтый, который представлен преимущественно жиром, и красный – основной орган кроветворения. В отличие от красного, желтый костный мозг не принимает участия в гемопоэзе.
Во время гемопоэза образуются клетки крови. Стартует гемопоэз в раннем эмбриональном периоде. Соответственно, существуют как эмбриональные кроветворные органы, так и те, что функционируют после рождения. К органам, которые отвечают за гемопоэз во время эмбрионального периода, относят желточный мешок, фетальную печень, селезенку и костный мозг. В желточном мешке появляются первые кроветворные стволовые клетки. Происходит это на 3-й неделе эмбриогенеза. Незадолго после, от 3-го месяца и до рождения, основным кроветворным органом плода становится печень, поскольку некоторые из стволовых клеток перемещаются туда. С 4-го же месяца эмбриогенеза начинается формирование клеток крови и в костном мозге. Кроме того, в кроветворении у плода участвуют тимус, лимфатические узлы и селезенка. В печени и селезенке сохраняются гемопоэтические стволовые клетки, находящиеся в «спящем» состоянии, чем часто объясняют факт возникновения за пределами костного мозга очагов кроветворения. Такое кроветворение называется экстрамедуллярным. Возникает оно при онкологических заболеваниях крови и в результате чрезмерной стимуляции гемопоэза.
Объем костномозговых полостей у только что родившегося ребенка составляет около 1,6 л., из которых красный костный мозг занимает почти 100% пространства. Когда человек взрослеет, происходит централизация кроветворения, при этом гемопоэтически активная ткань сохраняется в костях центральной части скелета. Общий объем костного мозга у взрослых достигает приблизительно 4 л.
Расположение гемопоэтической ткани у взрослого человека следующее: в костях таза ее больше всего – 40%, в телах позвонков значительно меньше – 28%, в костях черепа она составляет 13%, в эпифизах трубчатых костей и ребрах – 8%, в грудине меньше всего – только 2%. Оставшуюся часть костномозговых полостей занимает желтый костный мозг, являющийся, как вы помните, жировой тканью. При этом красный и желтый костный мозг находятся в равном соотношении: 1:1.
Структурно красный костный мозг подразделяется на: экстраваскулярный (собственно, гемопоэтическая ткань) и васкулярный, который состоит из широких венозных сосудов, называемых синусами. В сети ретикулиновых волокон внутри костных трабекул находится желеподобный дисперсный материал, который и является гемопоэтической тканью.
Кровоснабжение костного мозга называется перфузией. Его осуществляют основная питающая артерия и ее малые терминальные артериолы. Отток же крови происходит таким образом: по венозным капиллярам собирается кровь в центральный венозный синус через венозные сосуды. Стенки венозных сосудов состоят из следующих трех слоев клеток: адвентиции, базальной мембраны и эндотелия. Именно в ретикулуме – тонкой сети волокон соединительной ткани, образованной отростками адвентициальных клеток, располагаются кроветворные клетки. На объем гемопоэтического пространства влияют изменения в адвентициальных клетках: количество кроветворных клеток снижается, когда адвентициальные клетки увеличиваются из-за повышения содержания в них жира. Если рассматривать эту картину под микроскопом, она выглядит как трансформация красного костного мозга в желтый.
В тот момент, когда требования к кроветворению повышаются – адвентициальные клетки уменьшаются, тем самым способствуя увеличению гемопоэтического компонента костного мозга.
Что влияет на кроветворение?
Причины малокровия (анемии) многообразны. Самая распространенная из них — дефицит железа или витамина В12. Малокровие может сопутствовать многим заболеваниям. В связи с тем, что количество циркулирующей в теле крови установить довольно сложно (кроме того, дефицит жидкости организм восполняет путем ее изъятия из тканей), диагностика анемии основывается на оценке количественных показателей крови. Основным в анализе крови является содержание эритроцитов и лейкоцитов, а также концентрация гемоглобина.
Для стимуляции кроветворения (особенно выработки в красном костном мозге эритроцитов) врач назначает лекарства, в состав которых входят железо, кобальт, витамин В12, фолиевая кислота, а также печеночные экстракты.
Малокровие (анемия) — уменьшение в крови количества эритроцитов и гемоглобина. Основные симптомы: утомляемость, одышка, бледность кожи, плохая сопротивляемость инфекциям. Существует много причин возникновения анемии, например, значительная кровопотеря из-за травмы или в результате хронического кровотечения.
Дополнительно статьи на данную тему:
Строение и функции эритроцитов крови
Возрастные особенности красного костного мозга
Масса данного органа составляет 2-3 кг. У эмбриона за кроветворение отвечает желточный мешок. С шестой недели эту функцию выполняет печень, а с третьего месяца – селезенка. Костная ткань формируется во втором месяце. С 12-ой недели развиваются кровеносные сосуды и синусоиды. Вокруг них формируется ретикулярная ткань. С этого момента КМ функционирует как кроветворный орган.
После рождения орган занимает все костномозговое пространство. Жировые клетки появляются в ККМ после рождения. В возрасте 3 лет, все кости ребенка заполнены ККМ. Спустя год, он перерождается в жировой (желтый). В возрасте 25 лет желтый мозг полностью заменяет красный в трубчатых и плоских костях. У пожилых людей орган приобретает желатиновую консистенцию.
Регуляция гемопоэза
Кроветворение регулируется:
- факторами роста, обеспечивающими пролиферацию и дифференцировку СКК и последующих стадий их развития,
- факторами транскрипции, влияющими на экспрессию генов, определяющих направление дифференцировки гемопоэтических клеток,
- витаминами, гормонами.
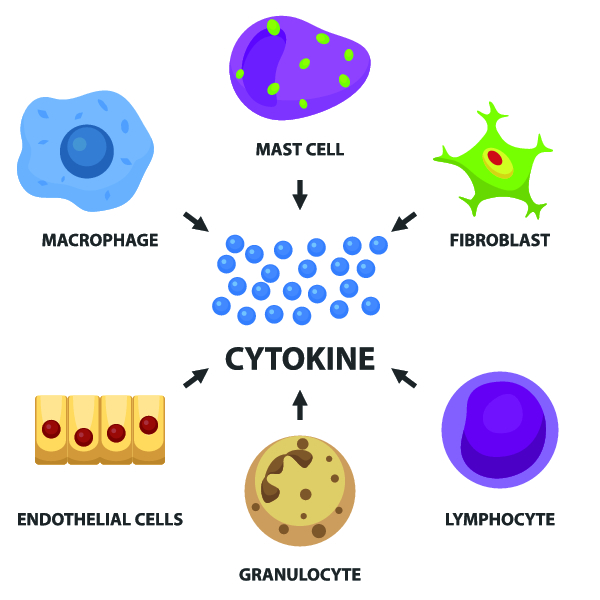
Факторы роста включают колониестимулирующие факторы (КСФ), интерлейкины и ингибирующие факторы. Они являются гликопротеинами, действующими и как циркулирующие гормоны, и как местные медиаторы, регулирующие гемопоэз и дифференцировку специфических типов клеток. Почти все факторы роста действуют на СКК, КОЕ, коммитированные и зрелые клетки. Однако отмечаются индивидуальные особенности действия этих факторов на клетки-мишени.
КСФ действуют на специфические клетки или группы клеток на различных стадиях дифференцировки. Например, фактор роста стволовых клеток влияет на пролиферацию и миграцию СКК в эмбриогенезе. В постнатальном периоде на гемопоэз оказывают влияние несколько КСФ, среди которых наиболее изучены факторы, стимулирующие развитие гранулоцитов и макрофагов (ГМ-КСФ, Г-КСФ, М-КСФ), а также интерлейкины.
Большинство указанных факторов выделено и применяется для лечения различных болезней. Для получения их используются биотехнологические методы.
Дифференцировка полипотентных клеток в унипотентные определяется действием ряда специфических факторов, поэтинов — эритропоэтинов (для эритробластов), гранулопоэтинов (для миелобластов), лимфопоэтинов (для лимфобластов), тромбопоэтинов (для мегакариобластов).
Большая часть эритропоэтина образуется в почках. Его образование регулируется содержанием в крови кислорода, которое зависит от количества циркулирующих в крови эритроцитов. Снижение числа эритроцитов и соответственно парциального давления кислорода, является сигналом для увеличения продукции эритропоэтина. Эритропоэтин действует на чувствительные к нему КОЕ-Э, стимулируя их пролиферацию и дифференцировку, что в конечном итоге приводит к повышению содержания в крови эритроцитов.
Тромбопоэтин синтезируется в печени, стимулирует пролиферацию КОЕ-МГЦ, их дифференцировку и образование тромбоцитов.
Ингибирующие факторы дают противоположный эффект, т.е. тормозят гемопоэз; их недостаток может быть одной из причин лейкемии, характеризующейся значительным увеличением числа лейкоцитов в крови. Выделен ингибирующий лейкемию фактор (ЛИФ), который тормозит пролиферацию и дифференцировку моноцитов-макрофагов.
Витамины необходимы для стимуляции пролиферации и дифференцировки гемопоэтических клеток. Витамин В12 поступает с пищей и соединяется с внутренним фактором (Касла), который синтезируется париетальными клетками желудка. Образуемый при этом комплекс, в присутствии ионов Са2+, соединяется с рецепторами эпителиоцитов подвздошной кишки и всасывается. При всасывании в эпителиоциты поступает лишь витамин В12, а внутренний фактор освобождается. Витамин В12 поступает с кровью в костный мозг, где влияет на гемопоэз, и в печень, где может депонироваться. Нарушение процесса всасывания при различных заболеваниях желудочно-кишечного тракта может служить причиной дефицита витамина В12 и нарушений в гемопоэзе.
Некоторые термины из практической медицины:
- анемия (син. малокровие) — состояние, характеризующееся снижением содержания гемоглобина в единице объема крови, чаще при одновременном уменьшении количества эритроцитов;
- анемия ахрестическая — общее название анемий, развивающихся вследствие неспособности эритробластов костного мозга использовать какие-либо антианемические факторы (цианокобаламин, фолиевую кислоту, железо и др.) при их нормальном поступлении в организм;
- хлороз ранний (син.: бледная немочь, хлороз ювенильный) — железодефицитная анемия у девушек в период полового созревания, проявляющаяся алебастровой бледностью кожи с зеленоватым оттенком, извращением вкуса, олигоменореей;
- хлороз поздний (син. анемия железодефицитная эссенциальная) — железодефицитная анемия у женщин в возрасте старше 30 лет, обычно связанная с маточными или другими кровотечениями, проявляющаяся извращением вкуса и обоняния, признаками атрофии слизистой оболочки полости рта и пищевода, выпадением волос, искривлением ногтей, позже — выраженными признаками анемии;
Эмбриональное кроветворение.
Кроветворение во внутриутробном периоде
развития начинается рано. По мере роста
эмбриона и плода последовательно
меняется локализация гемопоэза в
различных органах.
Табл. 1. Развитие гемопоэтической системы
человека
(по Н.С. Кисляк, Р.В. Ленской, 1978).
|
Локализация кроветворения |
Период эмбриогенеза (недели) |
|
Желточный мешок |
3 – 4 |
|
Начало кроветворения в печени |
5 – 6 |
|
Появление больших лимфоцитов в тимусе |
9 – 10 |
|
Начало гемопоэза в селезенке |
Конец 12-й |
|
Появление гемопоэтических очагов в |
13 – 14 |
|
Лимфопоэз в лимфоузлах |
16 – 17 |
|
Появление циркулирующих малых |
17 |
|
Начало лимфопоэза в селезенке |
20 |
Начинается кроветворение в желточном
мешке на 3-й неделе развития человеческого
эмбриона. В начале оно сводится в основном
к эритропоэзу. Образование первичных
эритробластов (мегалобласты) происходит
внутри сосудов желточного мешка.
На 4-й неделе кроветворение появляется
в органах эмбриона. Из желточного мешка
гемопоэз перемещается в печень, которая
к 5-й недели гестации становится центром
кроветворения. С этого времени наряду
с эритроидными клетками начинают
образовываться первые гранулоциты и
мегакариоциты, при этом мегалобластический
тип кроветворения сменяется на
нормобластический. К 18-20-й неделе развития
человеческого плода кроветворная
активность в печени резко снижена, а к
концу внутриутробной жизни, как правило,
совсем прекращается.
В селезенке кроветворение начинается
с 12-й недели, образуются эритроциты,
гранулоциты, мегакариоциты. С 20-й недели
миелопоэз в селезенке сменяется
интенсивным лимфопоэзом.
Первые лимфоидные элементы появляются
на 9-10 неделе в строме тимуса, в процессе
их дифференцировки образуются
иммунокомпетентные клетки – Т-лимфоциты.
К 20-й неделе тимус по соотношению малых
и средних лимфоцитов сходен с тимусом
доношенного ребенка, к этому времени в
сыворотке крови плода начинают
обнаруживаться иммуноглобулины М и G.
Костный мозг закладывается в конце 3-го
месяца эмбрионального развития за счет
мезенхимальных периваскулярных
элементов, проникающих вместе с
кровеносными сосудами из периоста в
костномозговую полость. Гемопоэтические
очаги в костном мозге появляются с 13-14
недели внутриутробного развития в
диафизах бедренных и плечевых костей.
К 15-й неделе в этих локусах отмечается
обилие юных форм грануло-, эритро- и
мегакариоцитов. Костномозговое
кроветворение становится основным к
концу внутриутробного развития и на
протяжении всего постнатального периода.
Костный мозг в пренатальном периоде
красный. Его объем с возрастом плода
увеличивается в 2,5 раза и к рождению
составляет порядка 40 мл. и он присутствует
во всех костях. К концу гестации начинают
появляться в костном мозге конечностей
жировые клетки. После рождения в процессе
роста ребенка масса костного мозга
увеличивается и к 20 годам составляет в
среднем 3000 г, но на долю красного костного
мозга будет приходиться порядка 1200 г,
и он будет локализоваться в основном в
плоских костях и телах позвонков,
остальная часть будет замещена желтым
костным мозгом.
Основным отличие состава форменных
элементов крови плода является постоянное
нарастание числа эритроцитов, содержания
гемоглобина, количества лейкоцитов.
Если в первой половине внутриутробного
развития (до 6 месяцев) в крови обнаруживаются
много незрелых элементов (эритробластов,
миелобластов, промиелоцитов и миелоцитов),
то в последующие месяцы в периферической
крови плода содержатся преимущественно
зрелые элементы.
Изменяется и состав гемоглобина. Вначале
(9-12 нед) в мегалобластах находится
примитивный гемоглобин (HbP),
который заменятся фетальным (HbF).
Он становится основной формой в
пренатальном периоде. Хотя с 10-й недели
начинают появляться эритроциты с
гемоглобином взрослого типа (HbA),
доля его до 30 недели составляет лишь
10%. К рождению ребенка фетальный гемоглобин
составляет приблизительно 60%, а взрослый
– 40% всего гемоглобина эритроцитов
периферической крови
Важным физиологическим
свойством примитивного и фетального
гемоглобинов является их более высокое
сродство к кислороду, что имеет важное
значение во внутриутробном периоде для
обеспечения организма плода кислородом,
когда оксигенация крови плода в плаценте
относительно ограничена по сравнению
с оксигенацией крови после рождения в
связи с установлением легочного дыхания
Тимус
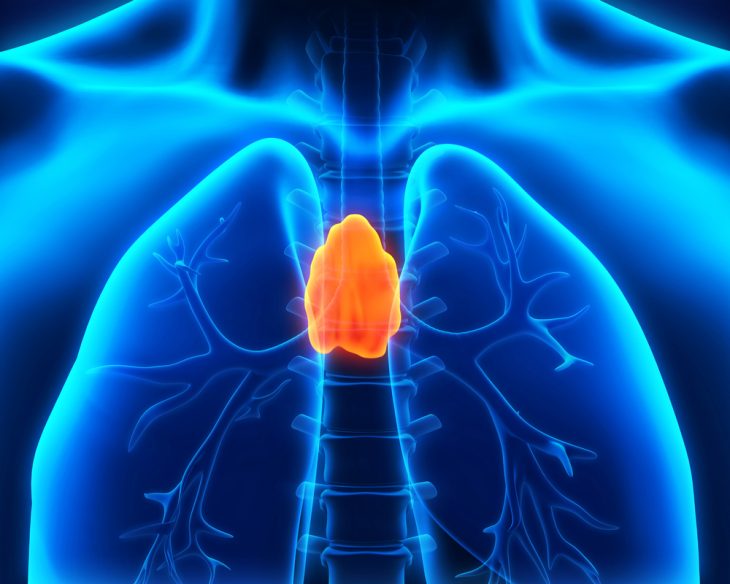 Тимус — важный орган кроветворения у детей и подростков.
Тимус — важный орган кроветворения у детей и подростков.
Это центральный лимфоидный орган, который располагается в верхних отделах средостения. Своего максимального развития тимус достигает в период полового созревания, затем подвергается обратному развитию. Однако никогда не замещается жировой тканью полностью.
В этом органе происходит созревание Т-лимфоцитов и их клональная селекция. Он состоит из двух крупных долей, которые разделяются на более мелкие дольки. В каждой из них выделяют два слоя (корковый и мозговой), которые тесно связаны между собой. В корковой зоне находятся менее зрелые тимоциты, сюда попадают предшественники Т-клеток из костно-мозговых очагов кроветворения.
Селезенка (splen, lien)
Селезенка – непарный орган удлиненной формы, расположенный в левом подреберье брюшной полости. Масса ее составляет 100-150 гр.
Функции:
- Кроветворная – размножение и антигензависимая дифференцировка Т- и В-лимфоцитов.
- Депонирущая – депо крови, железа, тромбоцитов (до 1/3 их общего числа).
- Эндокринная – синтез эритропоэтина – стимулирующего эритропоэз, тафтсина – пептида, стимулирующего активность фагоцитов, спленина – аналога тимопоэтина, стимулирующего бласттрансформацию и дифференцировку Т-лимфоцитов.
- Элиминация и разрушение старых эритроцитов и тромбоцитов.
- В эмбриональный период – универсальный орган кроветворения.
Развитие. Закладка селезенки происходит на 5-й неделе эмбриогенеза из мезенхимы дорсальной брыжейки. Вначале в селезенке экстраваскулярно образуются все форменные элементы крови, а после 5-го месяца эмбриогенеза в ней преобладает лимфопоэз.
Строение. Селезенка – паренхиматозный орган. Снаружи окружена соединительнотканной капсулой, покрытой мезотелием. Капсула представлена плотной волокнистой соединительной тканью, между коллагеновыми волокнами которой располагаются в небольшом количестве гладкие мышечные клетки. От капсулы отходят трабекулы, которые вместе образуют опорно-сократительный аппарат. Пространство между трабекулами заполнено ретикулярной тканью, образующей строму органа.
В Т- и в В-лимфоцитопоэзе выделяют три этапа:
- костномозговой этап;
- этап антиген—независимой дифференцировки, осуществляемый в центральных иммунных органах;
- этап антиген—зависимой дифференцировки, осуществляемый в периферических лимфоидных органах.
Первый этап Т-лимфоцитопоэза осуществляется в лимфоидной ткани красного костного мозга, где образуются следующие классы клеток:
- 1 класс — стволовые клетки;
- 2 класс — полустволовые клетки-предшественницы лимфоцитопоэза;
- 3 класс — унипотентные Т-поэтинчувствительные клетки—предшественницы Т-лимфоцитопоэза, эти клетки мигрируют в кровеносное русло и с кровью достигают тимуса.
Второй этап — этап антигеннезависимой дифференцировки осуществляется в корковом веществе тимуса. Здесь продолжается дальнейший процесс Т-лимфоцитопоэза. Под влиянием биологически активного вещества тимозина, выделяемого стромальными клетками, унипотентные клетки превращаются в Т-лимфобласты — 4 класс, затем в Т-пролимфоциты — 5 класс, а последние в Т-лимфоциты — 6 класс.
Третий этап — этап антигенезависимой дифференцировки осуществляется в Т-зонах периферических лимфоидных органов — лимфоузлов, селезенки и других, где создаются условия для встречи антигена с Т-лимфоцитом (киллером, хелпером или супрессором), имеющим рецептор к данному антигену.
Первый этап В-лимфоцитопоэза осуществляется в красном костном мозге, где образуются следующие классы клеток:
- 1 класс — стволовые клетки;
- 2 класс — полустволовые клетки-предшественницы лимфопоэза;
- 3 класс — унипотентные В-поэтинчувствительные клетки-предшественницы В-лимфоцитопоэза.
Второй этап антигеннезависимой дифференцировки у птиц осуществляется в специальном центральном лимфоидном органе — фабрициевой сумке.
Третий этап — антигензависимая дифференцировка осуществляется в В-зонах периферических лимфоидных органов (лимфатических узлов, селезенки и других) где происходит встреча антигена с соответствующим В-рецепторным лимфоцитом, его последующая активация и трансформация в иммунобласт.
За что отвечает желтый костный мозг
Желтый костный мозг обычно находится в диафизах трубчатых костей. Состоит из ретикулярной ткани и клеток адипоцитов, которые содержат специальный пигмент-липохром в центре полости длинных костей, а снаружи ее окружает слой красного костного мозга. Жир из адипоцитов, в случае крайней необходимости, например, после длительного голодания, организм может использовать в качестве источника энергии. В обычных условиях желтый костный мозг не участвует в гемопоэзе, но в исключительных случаях, например, после сильной кровопотери или при острой анемии, часть желтого костного мозга может превратиться в красный, чтобы ускорить восстановление крови.