Что такое эндотелий
Содержание:
- Введение
- Дисфункция эндотелия
- Лечение
- Характеристика различных типов поверхностных эпителиев, регенерация и возрастные изменения.
- Классификация капилляров
- Эндотелиальная клетка
- Оксид азота.
- АНГИОЦЕНТРИЧЕСКОЕ ВОСПАЛЕНИЕ
- Причины эндотелиальной дисфункции
- Функция эндотелия
- Результаты
- Диагностика эндотелиальной дисфункции сосудов
- Что такое сердце?
Введение
Течение COVID-19 состоит из ранней инфекционной фазы, когда вирус проникает в клетки легочного эпителия посредством рецепторов АСЕ2, вызывая вирусную пневмонию, и последующей фазы системного воспаления, характеризующуюся дыхательной декомпенсацией и мультиорганной дисфункцией (2).
Считается, что нарушения в концентрации цитокинов, в том числе ИЛ-6, играют роль в течении заболевания, что позволяет предположить, что рационально использовать тоцилизумаб у пациентов с новой коронавирусной инфекцией (3).
Среди важных черт COVID-19, следует выделить коагулопатию, характеризующуся высокими концентрациями D-димера и фибриногена с небольшими изменениями протромбинового времени и числа тромбоцитов (4, 5).
Так, COVID-19-ассоциированная коагулопатия приводит к протромботическому статусу с частотой развития венозных тромбоэмболий до 69% у пациентов в критическом состоянии, незасивимо от использования фармакологической тромбопрофилактики, равно как и к артериальным тромбозам (6, 7).
На аутопсиях часто обнаруживаются микрососудистые тромбозы легочных сосудов (8, 9).
В одном из одноцентровых исследований Китая была обнаружена сильная взаимосвязь между ДВС и летальностью у больных с новой коронавирусной инфекцией (4). Однако в других исследованиях предположили, что патофизиология коагулопатии при COVID-19 отличается от ДВС (5). Наличие эндотелиита и вирусных частиц в клетках эндотелия, как показала работа с небольшим количеством аутопсий пациентов с КОВИЗ-19, в сочетании с обнаружением рецептора АСЕ2 на клетках эндотелия, навело ученых на мысль о повреждении эндотелия или его активации, как о центральном свойстве патофизиологии COVID-19, в частности, во время воспалительной фазы заболевания (9, 10).
Чтобы лучше понять патологические механизмы, лежащие в основе COVID-19-коагулопатии, авторы провели биохимическое исследование, в котором оценивались маркеры активации клеток эндотелия и тромбоцитов у больных COVID-19 в критическом и не в критическом состояниях. Первичной целью было провести исследовательский анализ гемостатических факторов и маркеров активации эндотелия и тромбоцитов у пациентов с COVID-19, поступивших в ОРИТ, и у нереанимационных пациентов. Второй целью стало оценить взаимосвязь между этими маркерами и клиническими исходами, включая внутригоспитальную летальность и выписку из стационара.
Дисфункция эндотелия
Эндотелий балансирует противоположные начала: усиление — ослабление сосудистого тонуса, агрегация — дезагрегация клеток крови, увеличение — уменьшение числа сосудистых клеток.
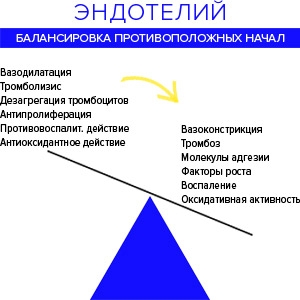
Результат определяется концентрацией синтезируемых им веществ, между которыми существуют строгая зависимость и равновесие. Но «маэстро кровообращения», — так эндотелий называл нобелевский лауреат, английский фармаколог Дж. Вейн, — с годами часто играет мимо нот.
Рис. 2. Регуляторные функции эндотелия. Нормальные или антиатерогенные эффекты, против дисфункции или атерогенных свойств.
Беспорядочное усиление роли одних эндотельных веществ и ослабление «оппозиционной» работы других, ведет к дисфункции сосудистого эндотелия, которая является ранним маркером развития сердечно-сосудистых заболеваний.
Дисфункция эндотелия — это, прежде всего, дисбаланс между продукцией вазодилатирующих, ангиопротективных, антипролиферативных факторов с одной стороны и вазоконстриктивных, протромботических, пролиферативных факторов, с другой стороны . То есть, если в первом случае сосуды нормально расширены и скольжению в них ничего не мешает, то в случае нарушений эндотелия движению крови препятствует спазм сосудов и прилипание лейкоцитов к эндотелию.
Эндотелий производит не только сосудорасширяющие, но и сосудосуживающие вещества. В сосуде с «нормальным» эндотелием, баланс его секреторной активности всегда сдвинут в сторону сосудорасширяющих факторов — готовность противостоять усилению тонуса.
Но в стареющем организме или в случае различных заболеваний (ишемии, системной или легочной гипертензии, сахарном диабете и др.), секреторный фенотип эндотелия меняется в сторону сосудосуживающих влияний: вместо расширения сосудов — их сокращение.
Таким образом, эндотелий играет ключевую роль в поддержании нормального тонуса, текучести крови, а также ограничении сосудистого воспаления.
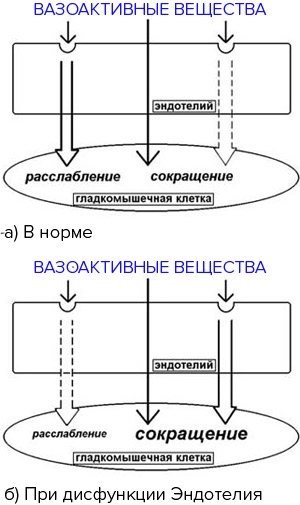
Рис. 3. Регуляция тонуса сосудов.
Нарушение тонко регулируемого баланса приводит к развитию эндотелиальной дисфункции.
Так, при наличии факторов риска сердечно-сосудистых заболеваний, эндотелиальные клетки теряют способность поддерживать регулируемый механизм: создаются условия для захвата эндотелием липидов и лейкоцитов (моноциты и Т-лимфоциты), стимулируется воспалительный ответ, и появляются жировые полоски, первая ступень формирования атероматозной бляшки.
Если состояние сохраняется, наблюдается прогрессирование атеросклероза и превращение жировой полоски в атеромную бляшку. Бляшка подвергается разрыву и создаются условия для тромбогенеза и окклюзии сосуда. Клинические синдромы, такие, как стабильная и нестабильная стенокардия, острый инфаркт миокарда, перемежающаяся хромота, и инсульт связаны, в частности, с нарушением эндотелиального контроля сосудистого тонуса, тромбозом, и структурными изменениями сосудистой стенки.
Лечение
Программа консервативной терапии:
- местное введение гипертонических солевых растворов;
- применение капель для улучшения трофики;
- нанесение глазных мазей, способствующих заживлению;
- обезболивание анальгетиками в виде капель или таблетками;
- процедура кросс-линкинга.
Солевой раствор захватывает и выводит избыточную жидкость из тканей. Зрение корректируют с помощью оптики — очками, лечебными контактными линзами.
Буллезные образования устраняют с помощью роговичного кросс-линкинга:
- с роговицы снимают эпителий;
- наносят рибофлавин;
- облучают особым спектром ультрафиолета.
В результате на роговой оболочке формируется новый каркас, предотвращающий ее деформацию.
Оперативное лечение — кератопластика. Показания:
- выраженная степень потери зрения;
- истончение роговицы;
- низкая плотность эндотелия.
Виды кератопластики:
- сквозная — полная пересадка роговой оболочки;
- послойная DSEK — пересадка десцеметовой мембраны с эндотелием.
 Поврежденную роговицу заменяют донорской тканью, биоимплантами. Послойная кератопластика проводится малоинвазивно. Трансплантат вводят через маленький разрез, разворачивают и фиксируют на строме струей воздуха.
Поврежденную роговицу заменяют донорской тканью, биоимплантами. Послойная кератопластика проводится малоинвазивно. Трансплантат вводят через маленький разрез, разворачивают и фиксируют на строме струей воздуха.
Характеристика различных типов поверхностных эпителиев, регенерация и возрастные изменения.
Однослойные однорядные эпителии
По форме клеток могут быть плоскими, кубическими, призматическими.
Однослойный плоский эпителий представлен в организме мезотелием и эндотелием.
Мезотелий покрывает серозные оболочки (листки плевры, брюшины, околосердечной сумки). Клетки мезотелия плоские, имеют полигональную форму и неровные края. На свободной поверхности клетки имеются микроворсинки. Через мезотелий происходят выделение и всасывание серозной жидкости. Благодаря его гладкой поверхности легко осуществляется скольжение внутренних органов. Мезотелий препятствует образованию спаек между органами брюшной или грудной полостей, развитие которых возможно при нарушении его целостности.
Эндотелий выстилает кровеносные и лимфатические сосуды, а также камеры сердца. Он представляет собой пласт плоских клеток — эндотелиоцитов, лежащих в один слой на базальной мембране. Эндотелий, располагаясь в сосудах на границе с лимфой или кровью, участвует в обмене веществ и газов между ними и другими тканями. При его повреждении возможны изменение кровотока в сосудах и образование в их просвете сгустков крови — тромбов.
Однослойный кубический эпителий выстилает часть почечных канальцев. Эпителий почечных канальцев выполняет функцию обратного всасывания (или реабсорбции) ряда веществ из первичной мочи в кровь.
Однослойный призматический эпителий характерен для среднего отдела пищеварительной системы. Он выстилает внутреннюю поверхность желудка, тонкой и толстой кишки, желчного пузыря, ряда протоков печени и поджелудочной железы. Эпителиальные клетки связаны между собой с помощью десмосом, щелевых коммуникационных соединений, по типу замка, плотных замыкающих соединений. Благодаря последним в межклеточные щели эпителия не может проникнуть содержимое полости желудка, кишки и других полых органов.
В желудке в однослойном призматическом эпителии все клетки являются железистыми, продуцирующими слизь, которая защищает стенку желудка от грубого влияния комков пищи и переваривающего действия желудочного сока. Меньшая часть клеток эпителия представляет собой камбиальные эпителиоциты, способные делиться и дифференцироваться в железистые эпителиоциты. За счет этих клеток каждые 5 сут происходит полное обновление эпителия желудка — т.е. его физиологическая регенерация.
В тонкой кишке эпителий однослойный призматический каемчатый, активно участвующий в пищеварении. Он покрывает в кишке поверхность ворсинок и, в основном, состоит из каемчатых эпителиоцитов, среди которых располагаются железистые бокаловидные клетки. Каемка эпителиоцитов образована многочисленными микроворсинками, покрытыми гликокаликсом. В нем и мембране микроворсинок находятся ансамбли ферментов, которые осуществляют мембранное пищеварение — расщепление (гидролиз) веществ пищи до конечных продуктов и всасывание их (транспорт через мембрану и цитоплазму эпителиоцитов) в кровеносные и лимфатические капилляры подлежащей соединительной ткани.
Благодаря камбиальным (бескаемчатым) клеткам каемчатые эпителиоциты ворсинок полностью обновляются в течение 5—6 сут. Бокаловидные клетки выделяют слизь на поверхность эпителия. Слизь защищает его и подлежащие ткани от механических, химических и инфекционных воздействий. Эндокринные клетки нескольких видов, также входящие в состав эпителиальной выстилки кишечника, секретируют в кровь гормоны, которые осуществляют местную регуляцию функции органов пищеварительного аппарата.
Классификация капилляров
По
структурно-функциональным особенностям
различают три типа капилляров:
соматический, фенестрированный и
синусоидный, или перфорированный.
Наиболее
распространенный тип капилляров
—соматический.
В таких капиллярах сплошная эндотелиальная
выстилка и сплошная базальной мембраной.
Капилляры соматического типа находятся
в мышцах, органах нервной системы, в
соединительной ткани, в экзокринных
железах.
Второй
тип — фенестрированные капилляры.
Они характеризуются тонким эндотелием
с порами в эндотелиоцитах. Поры затянуты
диафрагмой, базальная мембрана непрерывна.
Фенестрированные капилляры встречаются
в эндокринных органах, в слизистой
оболочке кишки, в бурой жировой ткани,
в почечном тельце, сосудистом сплетении
мозга.
Третий
тип — капилляры перфорированного
типа,
или синусоиды. Это капилляры большого
диаметра, с крупными межклеточными и
трансцеллюлярными порами (перфорациями).
Базальная мембрана прерывистая.
Синусоидные капилляры характерны для
органов кроветворения, в частности для
костного мозга, селезенки, а также для
печени.
Эндотелиальная клетка
Эндотелиальные клетки не только восстанавливают выстилку существующих кровеносных сосудов, но и создают новые сосуды. Это обязательно должно происходить у зародыша, чтобы сосудистая сеть не отставала от роста тела, и в тех тканях взрослого организма ( кость, стенка матки), которые подвергаются циклическим перестройкам, а также при заживлении повреждений.
Эндотелиальные клетки образуют одиночный слой, выстилающий все кровеносные сосуды и регулирующий обмен веществами между кровью и окружающими тканями. Новые кровеносные сосуды развиваются из стенок существующих мелких сосудов в виде выростов эндотелиалъных клеток; эти клетки способны образовывать полые капиллярные трубочки даже при росте в культуре. В живом организме поврежденные ткани и некоторые опухоли обеспечивают себе кровоснабжение, выделяя вещества, которые стимулируют образование новых капиллярных веточек близлежащими эндотелиальными клетками. Рост опухолей, не способных вызвать такую реакцию эндоте-лиальных клеток, быстро прекращается.
Эндотелиальные клетки, выстилающие внутреннюю поверхность кровеносных сосудов, имеют постоянный контакт с циркулирующим пулом клеток крови.
Эндотелиальные клетки секретируют во внешнюю среду GM-CSF, IL-1, 6, 7, TNFa, хемокины и другие вещества, играющие роль инициаторов и регуляторов иммунных реакций.
|
Юкстаканаликулярная ткань в глазу с начальной простой глаукомой. |
Эндотелиальные клетки внутренней стенки синуса не имеют выраженной базальной мембраны. Они лежат на очень тонком неравномерном слое волокон ( преимущественно эластических), связанных основной субстанцией. Короткие эндоплазматические отростки клеток проникают в глубь этого слоя, что увеличивает прочность их соединения с юкстаканаликулярной тканью.
Распад эндотелиальных клеток и перицитов расценивается в качестве неспецифического эффекта при дегенерациях, ретинопа-тиях и окклюзии сосудов. Ацелюлярные капилляры легко запу-стевают, циркуляция крови в них прекращается.
Паразитируют в красных кровяных и эндотелиальных клетках человека и животных ( млекопитающих, птиц и пресмыкающихся); весь жизненный никл проходит внутри тела хозяина.
Интересно, что эндотелиальные клетки в результате активации тоже могут продуцировать окись азота во внеклеточную среду.
Простациклины образуются в эндотелиальных клетках эндокарда и сосудов. Они препятствуют агрегации тромбоцитов; расширяют коронарные сосуды и снижают давление крови, действуя на гладкие мышцы сосудов.
Во всей сосудистой системе взрослого организма эндотелиальные клетки сохраняют способность к делению и передвижению. Если, например, участок стенки аорты будет поврежден и лишится своей эндотелиальной выстилки, в окружающем эндотелии образуются новые клетки, которые перемещаются так, чтобы покрыть поврежденное место. Новые клетки способны даже покрывать внутреннюю поверхность пластиковых трубок, используемых хирургами для замещения поврежденных частей кровеносных сосудов.
|
Опухолевая ткань, пересаженная в роговицу, выделяет фактор, вызывающий прорастание в опухоль капилляров. Капилляры обеспечивают опухоль питательными веществами из общего кровотока, и это позволяет ей расти. Процесс образования капилляров называется ангиогене-зом. |
Такого рода наблюдения показывают, что эндотелиальные клетки, которые в будущем сформируют новый капилляр, отрастают от стенки существующего капилляра или небольшой венулы, выпуская сначала псевдоподии ( рис. 16 — 17); затем образуется толстый отросток, который позже становится полым и превращается в трубку. Первый признак образования такой трубочки в культуре-это появление в клетке удлиненной вакуоли, которая вначале полностью окружена цитоплазмой. Такие же вакуоли возникают в соседних клетках, и в конце концов клетки выстраивают свои вакуоли концом к концу так, что эти вакуоли сливаются в один непрерывный канал. Капилляры, образующиеся в чистой культуре эндотелиальных клеток, не содержат крови, и по ним не протекает никакая жидкость. Очевидно, что ток и давление крови не нужны для образования капиллярной сети.
Новый кровеносный капилляр образуется путем отпочковывания эндотелиальной клетки от стенки существующего малого сосуда. Эта схема основана на наблюдениях над клетками в прозрачном хвосте живого головастика.
|
Нарушение проницаемости стенки сосудов сетчатки, экстравазаль-ная флюоресценция у больного препролиферативной диабетической ретинопатией. Флюоресцентная ангиограмма, поздняя венозная фаза. |
Оксид азота.
Одной из самых важных молекул, продуцируемых эндотелием, является оксид азота, конечная субстанция, осуществляющая многие регуляторные функции. Синтез оксида азота осуществляется из L-аргинина конститутивным ферментом NO-синтазой. К настоящему времени идентифицированы три изоформы NO-синтаз, каждая из которых представляет собой продукт отдельного гена, кодируется и идентифицируется в разных типах клеток. В эндотелиальных клетках и в кардиомиоцитах имеется так называемая NO-синтаза 3 (есNOs или NOs3)
Оксид азота присутствует во всех типах эндотелия. Даже в покое эндотелиоцит синтезирует определенное количество NO, поддерживая базальный тонус сосудов.
При сокращении мышечных элементов сосуда, снижении парциального напряжения кислорода в ткани в ответ на повышение концентрации ацетилхолина, гистамина, норадреналина, брадикинина, АТФ и др. синтез и секреция NO эндотелием усиливается. Продукция оксида азота в эндотелии также зависит от концентрации кальмодулина и ионов Са2+.
Функция NO сводится к торможению работы сократительного аппарата гладкомышечных элементов. При этом активируется фермент гуанилатциклаза и образуется посредник (мессенджер) – циклический 35-гуанозинмонофосфат.
Установлено, что инкубация эндотелиальных клеток в присутствии одного из провоспалительных цитокинов – TNFa – приводит к уменьшению жизнеспособности эндотелиальных клеток. Но если усиливается образование оксида азота, то эта реакция защищает эндотелиальные клетки от действия TNFa. В то же время ингибитор аденилатциклазы 25-дидезоксиаденозин полностью подавляет цитопротекторный эффект донора NO. Следовательно, одним из путей действия NO может быть цГМФ-зависимое ингибирование распада цАМФ.
Что же делает NO?
Оксид азота тормозит адгезию и агрегацию тромбоцитов и лейкоцитов, что связано с образованием простациклина. Одновременно он ингибирует синтез тромбоксана А2 (ТхА2). Оксид азота тормозит активность ангиотензина II, вызывающего повышение тонуса сосудов.
NO регулирует локальный рост эндотелиальных клеток. Являясь свободнорадикальным соединением с высокой реактивной способностью, NO стимулирует токсическое действие макрофагов на опухолевые клетки, бактерии и грибки. Оксид азота противодействует оксидантному повреждению клеток, вероятно, из-за регуляции механизмов синтеза внутриклеточного глутатиона.
С ослаблением генерации NO связано возникновение гипертензии, гиперхолестеринемии, атеросклероза, а также спастических реакций коронарных сосудов. Кроме того, нарушение генерации оксида азота приводит к дисфункции эндотелия, касающейся образования биологически активных соединений.
АНГИОЦЕНТРИЧЕСКОЕ ВОСПАЛЕНИЕ
Фигура 1.Лимфоцитарное воспаление в легких у пациента, умершего от Covid-19.
Все образцы легкого из группы Covid-19 имели диффузное альвеолярное повреждение с некрозом клеток альвеолярной оболочки, гиперплазией пневмоцитов 2 типа и линейным внутриальвеолярным отложением фибрина ( рис. 1 ). В четырех из семи случаев изменения были очаговыми, только с легким интерстициальным отеком. Оставшиеся три случая имели гомогенные отложения фибрина и выраженный интерстициальный отек с ранней внутриальвеолярной организацией. Образцы в группе гриппа имели диффузное диффузное альвеолярное повреждение с массивным интерстициальным отеком и обширным отложением фибрина во всех случаях. Кроме того, три образца в группе гриппа имели очаговую организацию и резорбтивное воспаление (рис. S2). Эти изменения были отражены в значительно более высоком весе легких от пациентов с гриппом.
Иммуногистохимический анализ экспрессии ангиотензинпревращающего фермента 2 (ACE2), измеренный как среднее (± SD) относительное количество ACE2-положительных клеток на поле зрения, в неинфицированных контрольных легких показал недостаточную экспрессию ACE2 в альвеолярных эпителиальных клетках (0,053 ± 0,03) и капиллярные эндотелиальные клетки (0,066 ± 0,03). В легких пациентов с Covid-19 и легких пациентов с гриппом относительные количества ACE2-позитивных клеток на поле зрения составляли 0,25 ± 0,14 и 0,35 ± 0,15 соответственно для альвеолярных эпителиальных клеток и 0,49 ± 0,28 и 0,55 ± 0,11. соответственно для эндотелиальных клеток. Кроме того, ACE2-позитивные лимфоциты не были обнаружены в периваскулярной ткани или в альвеолах контрольных легких, но присутствовали в легких в группе Covid-19 и в группе гриппа (относительные значения 0,22 ± 0,18 и 0,15 ± 0,09 соответственно) ,
В легких пациентов с Covid-19 и пациентов с гриппом аналогичные средние (± SD) количества CD3-позитивных Т-клеток были обнаружены в радиусе 200 мкм от предкапиллярных и посткапиллярных стенок сосудов в 20 областях исследования на пациента (26,2 ± 13,1 для Covid-19 и 14,8 ± 10,8 для гриппа). При том же размере поля, использованном для исследования, CD4-позитивные Т-клетки были более многочисленными в легких от пациентов с Covid-19, чем в легких от пациентов с гриппом (13,6 ± 6,0 против 5,8 ± 2,5, P = 0,04), тогда как CD8- положительные Т-клетки были менее многочисленными (5,3 ± 4,3 против 11,6 ± 4,9, р = 0,008). Нейтрофилы (CD15-положительные) были значительно менее многочисленными, прилегающими к альвеолярной эпителиальной оболочке в группе Covid-19, чем в группе гриппа (0,4 ± 0,5 против 4,8 ± 5,2, P = 0,002).
Мультиплексный анализ экспрессии генов, связанных с воспалением, с исследованием 249 генов из nCounter Inflammation Panel (NanoString Technologies) выявил сходства и различия между образцами в группе Covid-19 и в группе гриппа. В общей сложности 79 генов, связанных с воспалением, были дифференциально отрегулированы только в образцах от пациентов с Covid-19, тогда как 2 гена были дифференциально отрегулированы только в образцах от пациентов с гриппом; общий ген экспрессии был обнаружен для 7 генов (рис. S1).
Причины эндотелиальной дисфункции
Поскольку эндотелий так важен для многих жизненно важных функций, проводится много исследований, чтобы понять все причины эндотелиальной дисфункции. В этот момент очевидно, что эндотелиальная дисфункция связана со снижением уровня оксида азота (NO) в стенках кровеносных сосудов.
Оксиды азота представляют собой газ, который образуется в результате метаболизма аминокислоты (L-аргинин). Оксиды азота, имеющие очень короткий период полураспада, действуют локально в кровеносных сосудах, помогая модулировать тонус сосудов и другие важные эндотелиальные функции.
Дефицит продукции NO приводит к избыточному сужению кровеносных сосудов (которое может вызвать артериальную гипертензию), способствует активации тромбоцитов (приводит к свертыванию крови), увеличивает стимуляцию воспаления в стенках кровеносных сосудов (что способствует атеросклерозу) и увеличивает проницаемость стенок сосудов для повреждения липопротеинов и различных токсинов.
Подводя итог, можно сказать, что эндотелиальная дисфункция характеризуется снижением уровня оксида азота (NO) в сосудах, что, в свою очередь, приводит к нескольким нарушениям функции кровеносных сосудов. Эти функциональные нарушения способствуют развитию сердечно-сосудистых патологий.
Кроме того, эндотелиальная дисфункция может непосредственно вызывать аномальное сужение мелких артерий, и считается, что она является основным фактором, вызывающим кардиальный синдром Х и, возможно, диастолическую дисфункцию.
Нарушения и расстройства, сопутствующие эндотелиальной дисфункции

Точные причины, по которым у человека развивается эндотелиальная дисфункция, все еще изучаются. Тем не менее, очевидно, что этому способствуют многочисленные медицинские расстройства, привычки и неизбежные жизненные события, в том числе:
- повышенное кровяное давление (артериальная гипертензия);
- сахарный диабет;
- повышенные уровни холестерина и триглицеридов ЛПНП;
- курение;
- сидячий образ жизни;
- эмоциональный стресс (считается, что стрессовая кардиомиопатия, также известная как «синдром разбитого сердца» или кардиомиопатия Такоцубо, возникает в результате острой и тяжелой формы эндотелиальной дисфункции);
- инфекционные заболевания;
- сердечная недостаточность;
- гипотиреоз;
- остеопороз;
- естественное старение;
- химиотерапия и лучевая терапия;
- генетические влияния.
Функция эндотелия
Возможно, вы слышали, что кровь описывается как «река тела», по которой передаются сообщения и запасы между клетками и органами.
То, что вы не могли бы понять, что эта река должна быть жестко регулируется. Нельзя допустить, чтобы он был слишком низким или слишком высоким, и необходимо принимать решения о том, какие материалы и сообщения отправляются вместе с ним.
Функционирование всего организма зависит от этого, поскольку клетки и органы могут функционировать, только если их потребности удовлетворены и если они получают правильные сообщения через кровь.
Эндотелий может выглядеть не очень, если вы посмотрите на него во время вскрытия или под микроскопом. Он выравнивает кровеносные сосуды и выглядит как целлофановая полиэтиленовая пленка.
Но на молекулярном уровне эпителий выполняет много важных задач, которые жизненно важны для поддержания здоровья нашего тела.
Некоторые из этих задач:
- Мониторинг и контроль выброса электролитов и воды в кровь.
- Контроль артериального давления путем расслабления или сокращения в ответ на гормональные и нервные сигналы.
- Предотвращает свертывание крови внутри сосудов. Клетки на самом деле содержат и высвобождают анти-свертывающие факторы по мере необходимости!
- Селективная проницаемость – он хранит вещи, которые не должны быть в крови, в то время как он хранит вещи, которые должны быть в крови внутри сосудов. Эндотелий, например, пропускает лейкоциты между тканями и кровеносными сосудами, но не бактерии,
- Рост и ремонт кровеносных сосудов.
- Иммунные и воспалительные реакции.
«Эндотелиальная дисфункция» – когда ваш эндотелий не выполняет некоторые из этих работ должным образом – может быть симптомом и причиной многих заболеваний.
Эндотелиальная дисфункция может играть роль в повышенном кровяном давлении, если эндотелиальные клетки не высвобождают надлежащие антисвертывающие факторы. Эндотелиальные проблемы могут также привести к воспалительным иммунным реакциям, которые повреждают органы, и образованию сгустков крови в артериях.
Врачи часто видят эндотелиальную дисфункцию у людей с сердечно-сосудистыми заболеваниями, диабетом, высоким кровяным давлением, людьми с высоким уровнем холестерина и людьми, которые курят.
Результаты
68 пациентов (48 реанимационных, 20 нереанимационных). 13 негоспитализированных бессимптомных контрольных участников включили как группу сравнения для измерения специфических биомаркеров эндотелия и тромбоцитов, не имеющих стандартных референсных значений. Параметры коагуляции смотрели у всех пациентов, а биомаркеры тромбоцитов и эндотелия у 50 (40 реанимационных и 10 нереанимационных).
Более половины пациентов страдали ожирением, гиперлипидемией и диабетом. У трех пациентов был активный онкологический процесс, у троих – цирроз, у одного – трансплантация печени по поводу цирроза в анамнезе.
41 (60%) пациент получали антикоагулянты в профилактической дозе, 13 (19%) – промежуточную дозу антикоагулянтов (эноксапарин 0,5 мг/кг дважды в день), и 11 (16%) – терапевтические дозы антикоагулянтов, три пациента (4) вообще не получали антикоагулянты.
48 (71%) пациентов, все, кроме двух реанимационных больных, получали тоцилизумаб до того, как им измеряли показатели коагуляции.
Среди всех проанализированных характеристик, статистическая значимость для попадания в ОРИТ или не в ОРИТ была получена только для пола.
Маркеры активации эндотелиальных клеток и тромбоцитов были значимо повышены у реанимационных пациентов, по сравнению с нереанимационными, включая антиген фактора фон Виллебранда (среднее значение 565% (СО 199) у пациентов в ОРИТ по сравнению с 278% (133) у нереанимационных больных, p<0,00001) и растворимый Р-селектин (15,9 нг/мл (4,8) по сравнению с 11,2 нг/мл (3,1), р=0,0014). Кроме того, концентрации антигена фактора фон Виллебранда были повышены у 16 (80%) из 20 нереанимационных пациентов.
Авторы обнаружили, что летальность значимо коррелировала с уровнем антигена фактора фон Виллебранда (r=0,38; р=0,0022) и растворимого тромбомодулина (r=0,38; р=0,0078) у всех пациентов.
У всех пациентов концентрация растворенного тромбомодулина выше, чем 3,36 нг/мл была связана с более низкой частотой выписки из стационара (22 из 25 пациентов с низкой концентрацией по сравнению с 13 из 25 пациентов с высокой концентрацией, р=0,050) и более низкой вероятность выжить согласно данным анализа Каплана-Майера (отношение рисков 5,9, 95% Ди 1,9-18,4, р=0,0087).
Диагностика эндотелиальной дисфункции сосудов
Своевременное выявление данного недуга позволяет предотвратить и «последующие» болезни, вплоть до инфаркта
Очень важно вычислить сосудистый участок, на котором эндотелий дисфункционален. Состояние эндотелия на данном участке (например, в коронарных сосудах или в артерии) может быть проверено ангиограммой или ультразвуковыми исследованиями
В обоих случаях пациенту назначают прием сосудорасширяющих препаратов (как правило, ацетилхолин).
Еще один метод диагностики: измерение «времени передачи пульса» (Pulswellenlaufzeit, также pulsetransittime, или PTT) – важного кардиоваскулярного показателя, отражающего, в частности, степень эластичности сосудов. Если выявляется недостаточная эластичность, это может указывать среди прочего и на эндотелиальную дисфункцию
Обычно время передачи пульса устанавливается на участке от сердца до указательного пальца. Начало пульса (сокращение сердечной мышцы) регистрируется на электрокардиограмме. При этом учитываются ЭКГ-максимумы, так называемые R-зубцы. А момент «добегания волны пульса» до указательного пальца фиксируется пульсоксиметром, который, вообще говоря, применяется для определения насыщения крови кислородом («прищепка», прицепленная к указательному пальцу пациента, являющаяся спектрофотометрическим датчиком).
Что такое сердце?
Мы все знаем, что этот орган жизненно важен для человека. Обычно люди представляют его себе в виде этакого насоса, ритмично перекачивающего кровь. Именно сердце – это основной компонент обращения крови, лимфы в нашем организме. Сердце одновременно представляет собой и слоистую структуру с тремя оболочками, и паренхиматозный комплекс, поскольку присутствуют паренхима, строма.
Сердечные функции:
- насос (сокращения позволяют контролировать уровень давления);
- эндокринная (производство натрийуретического фактора);
- информативная (кодирование данных о состоянии организма через давление, скорость тока крови).
На основании сведений, передаваемых от сердца в отдельные ткани организма, корректируется активность обмена веществ.